Chemie-Lerner
Was ist Radon
Radon (Aussprache: RAY-don) ist ein geruchloses, radioaktives Element, das zur Familie der Edelgase gehört und durch das chemische Symbol Rn dargestellt wird. Es ist bei Raumtemperaturen farblos, wird aber phosphoreszierend, wenn es unter seine Gefriertemperatur abgekühlt wird, und färbt sich allmählich orange-rot, wenn die Temperatur weiter bis zum Siedepunkt von flüssiger Luft gesenkt wird .

Radonsymbol
Isotope
Es gibt mehr als 35 radioaktive Isotope des Radons, die von 195Rn-229Rn reichen, von denen 222Rn das stabilste ist mit einer Halbwertszeit von 3.823 Tagen und bildet 218Po durch α-Zerfall. Es hat vier natürlich vorkommende Isotope, darunter 218Rn, 219Rn, 220Rn und 222Rn.
Wo findet man Radon
Radon kommt in der Natur immer vor, da es aus der radioaktiven Zersetzung von Radium-226 entsteht, das in Phosphatgestein, Uranerzen, metamorphem Gestein und gewöhnlichem Gestein wie Kalkstein vorkommt. Eine kleine Menge Radon kommt auch in der Atmosphäre vor.

Radon Test Kit
Geschichte
Ursprung des Namens: Es ist nach dem radioaktiven Metallelement Radium benannt, weil Radon erstmals beim radioaktiven Zerfall von Radium nachgewiesen wurde.
Wer hat es entdeckt: Der deutsche Physiker Friedrich Ernst Dorn ist für seine Entdeckung bekannt.
Wann und wie wurde es entdeckt
Im Jahr 1899 fanden Robert B. Owens und Ernest Rutherford ein radioaktives Gas, das von Thorium ausging. Im selben Jahr entdeckten Marie und Pierre Curie ein Gas, das von Radium freigesetzt wurde. Im Jahr 1900 entdeckte Ernst Dorn bei der Untersuchung der Zerfallskette von Radium in der deutschen Stadt Halle ein Gas.
Wir wissen heute, dass das von den Curies und Ernst Dorn beobachtete radioaktive Gas Radon-222 war, während das von Rutherford entdeckte Gas Radon-220 war. Im Jahr 1908 sammelten Robert Whytlaw-Gray und William Ramsay genügend Radon und bestimmten die Eigenschaften von Radon am University College in London .
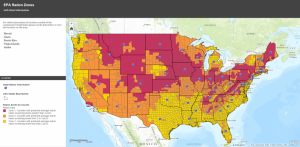
Epa Radon Gas Map
Radon Kennung |
|||
| Atomzahl | 86 | ||
| CAS-Nummer | 10043-92-2 | ||
| Position im Periodensystem | Gruppe | Periode | Block |
| 18 | 6 | p | |
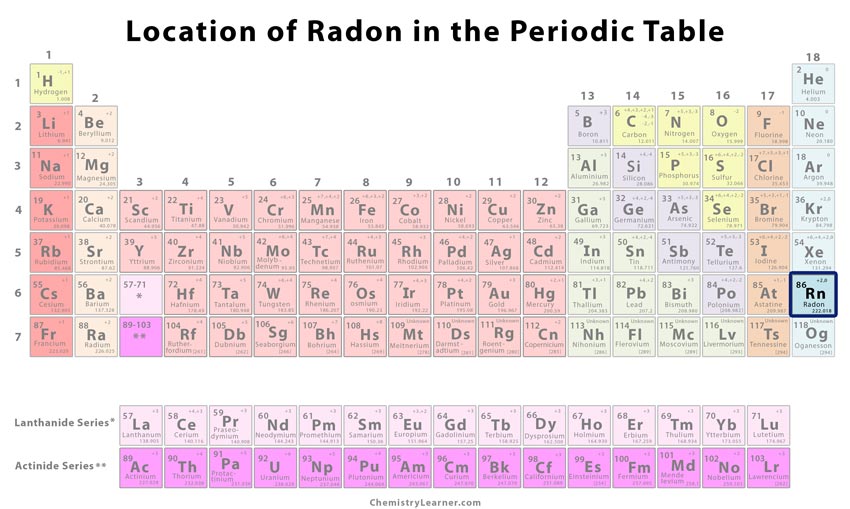
Lage von Radon im Periodensystem
Eigenschaften und Merkmale von Radon
Allgemeine Eigenschaften |
||||||||||||||||
| Relative Atommasse | ||||||||||||||||
| Atomische Masse | amu | |||||||||||||||
| Molare Masse | 210.9906010 ± 0.0000070 g/mol | |||||||||||||||
Physikalische Eigenschaften |
||||||||||||||||
| Farbe | Farblos | |||||||||||||||
| Schmelzpunkt/Gefrierpunkt | -71 °C, -96 °F | |||||||||||||||
| Siedepunkt | -61.7 °C, -79.1 °F | |||||||||||||||
| Dichte | 0.009074 g cm-3 | |||||||||||||||
| Zustand der Materie bei Raumtemperatur (fest/flüssig/gasförmig) | Gas | |||||||||||||||
| Ladung | Unbekannt | |||||||||||||||
| Thermische (Wärme-)Leitfähigkeit | 0.00361 W/(m K) | |||||||||||||||
| Brennbarkeit | Nicht brennbar | |||||||||||||||
| Spezifische Wärme | 94 J kg-1 K-1 | |||||||||||||||
| Blockmodul | Unbekannt | |||||||||||||||
| Schermodul | Unbekannt | |||||||||||||||
| Jungscher Modul | Unbekannt | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| – Temperatur (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Druck (Pa) | – | – | – | – | – | – | – | – | – | – | – | |||||
Chemische Eigenschaften |
||||||||||||||||
| Oxidationsstufen | 2 | |||||||||||||||
| Isotope | Isotope | Masse | Abundanz (%) | Halb-Lebensdauer | Zerfallsart | |||||||||||
| 211Rn | 210.991 | – | 14.6 h | β+, EC | ||||||||||||
| – | α | |||||||||||||||
| 220Rn | 220.011 | – | 55.6 s | α | ||||||||||||
| 222Rn | 128.905 | – | 3.823 d | α | ||||||||||||
Atomische Daten von Radon (Element 86)
| Valenz-Elektronen | 8 | |||||||
| Quantenzahlen | ||||||||
| – n | 6 | |||||||
| – ℓ | 1 | |||||||
| – mℓ | 1 | |||||||
| – ms | -1/2 | |||||||
| Elektronenkonfiguration (Edelgaskonfiguration) | 4f145d106s26p6 | |||||||
| Atomische Struktur | ||||||||
| – Anzahl der Elektronen | 86 | – Anzahl der Neutronen | 136 | |||||
| – Anzahl der Protonen | 86 | |||||||
| Radius des Atoms | ||||||||
| – Atomradius | 2.20 Å | |||||||
| – Kovalenter Radius | 1.46 Å | |||||||
| Elektronegativität (Pauling-Skala) | Unbekannt | |||||||
| Elektronenaffinität | Nicht stabil | |||||||
| Ionisierungsenergie (kJ mol-1) | 1st | 2nd | 3rd | 4th | 5th | 6. | 7. | 8. |
| 1037.073 | – | – | – | – | – | – | – | |
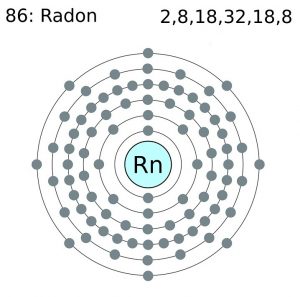
Radon-Elektron Konfiguration (Bohr’sches Modell)
Wofür wird es verwendet
- Die radioaktive Zersetzung von Radon ist nützlich zur Gewinnung von Polonium .
- Radon, das von einer Radiumquelle emittiert wird, kann in der Krebstherapie verwendet werden . Es wurde häufig in Krankenhäusern zur Behandlung von Tumoren durch Implantation von winzigen Röhrchen verwendet, in denen das Gas eingeschlossen war . Heute ist es durch sicherere Behandlungsmöglichkeiten ersetzt worden.
- Radon-Testkits werden für die Analyse von Radonwerten in Innenräumen an Orten verwendet, an denen sich große Konzentrationen von Radongas in Innenräumen ansammeln können. Wenn das Testergebnis zeigt, dass der Wert 4 pCi/L oder mehr beträgt, werden Minderungssysteme eingesetzt, um die Radonkonzentration zu reduzieren.
- Forscher verwenden die Radonkonzentration im Boden, um unterirdische geologische Verwerfungen zu kartieren, da die Konzentrationen im Allgemeinen über den Verwerfungen ansteigen. Grundwasser-Radon-Konzentrationen werden auch zur Erdbebenvorhersage analysiert.
Radon-Toxizität und gesundheitliche Auswirkungen
Die Zerfallsprodukte von Radon gelten als krebserregend. Da es eingeatmet werden kann, sind Menschen, die hohen Radonkonzentrationen ausgesetzt sind, dem Risiko ausgesetzt, Lungenkrebs zu entwickeln. Die Wahrscheinlichkeit, an Lungenkrebs zu erkranken, ist bei Rauchern, die Radon ausgesetzt sind, wesentlich höher. Es wird vermutet, dass es eine Rolle in der Evolution gespielt hat und für die Hintergrundstrahlung der Erde verantwortlich sein könnte, die genetische Veränderungen verursachen kann.
Interessante Fakten
- Es ist das schwerste bekannte chemisch inaktive Gas, das nur unter extremen Bedingungen Verbindungen mit anderen Substanzen eingehen kann.
- Es wird grafisch durch ein Bild des Symbols für Strahlengefahr mit Hintergrundbildern von Häusern dargestellt, was darauf hinweist, dass sich das Gas in Häusern ansammeln kann .
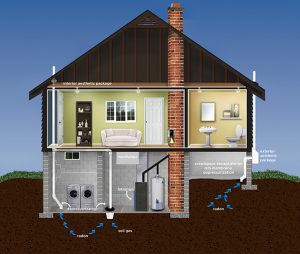
Radon Mitigation System
Radon Kosten
Der Preis für Radongas liegt bei etwa 4 $ pro m .
- http://www.rsc.org/periodic-table/element/86/radon
- https://education.jlab.org/itselemental/ele086.html
- http://www.chemistryexplained.com/elements/P-T/Radon.html
- https://www.livescience.com/39546-radon.html
- https://education.jlab.org/itselemental/iso086.html
- https://www.webqc.org/molecular-weight-of-radon.html
- https://www.chemicool.com/elements/radon.html
- http://www.cabrillo.edu/~aromero/Common%20Files/Periodic%20Table%20(Common%20Ionic%20Charges).pdf
- http://periodictable.com/Elements/086/data.html
- https://www.atsdr.cdc.gov/toxprofiles/tp145-c4.pdf
- http://chemistry-reference.com/q_elements.asp?Symbol=Rn&language=en
- https://sosradon.org/mitigation
- http://www.ipgp.fr/~klinger/page_web/biblio/publication/Richon_RadMeas2010%20.pdf
- https://www.jstage.jst.go.jp/article/jpe1952/43/5/43_5_585/_pdf
- https://www.epa.gov/radon/health-risk-radon
- https://hobart.k12.in.us/ksms/PeriodicTable/radon.htm