Aprendiz de Química
Qué es el Radón
El Radón (pronunciación: RAY-don) es un elemento inodoro y radiactivo que pertenece a la familia de los gases nobles y se representa con el símbolo químico Rn . Es incoloro a temperatura ambiente, pero se vuelve fosforescente cuando se enfría por debajo de su temperatura de congelación y se convierte gradualmente en rojo anaranjado cuando la temperatura se reduce aún más hasta el punto de ebullición del aire líquido .

Símbolo del radón
Isótopos
Existen más de 35 isótopos radiactivos del radón, que van desde el 195Rn-229Rn, de los cuales el 222Rn es el más estable con un periodo de semidesintegración de 3.823 días y forma el 218Po mediante α-decadencia. Tiene cuatro isótopos naturales, incluyendo 218Rn, 219Rn, 220Rn y 222Rn.
Dónde se encuentra el radón
El radón se encuentra siempre en la naturaleza porque se produce a partir de la descomposición radiactiva del radio-226 que está presente en las rocas de fosfato, los minerales de uranio, las rocas metamórficas y las rocas comunes como la caliza . Una pequeña cantidad de radón también se encuentra en la atmósfera.

Kit de prueba de radón
Historia
Origen de su nombre: Su nombre se debe al elemento metálico radiactivo radio porque el radón se identificó por primera vez durante la desintegración radiactiva del radio.
Quién lo descubrió: El físico alemán Friedrich Ernst Dorn es conocido por su descubrimiento .
Cuándo y cómo se descubrió
En 1899, Robert B. Owens y Ernest Rutherford encontraron un gas radiactivo que emanaba del torio . Ese mismo año, Marie y Pierre Curie detectaron un gas que emanaba del radio . En 1900, Ernst Dorn descubrió un gas mientras estudiaba la cadena de desintegración del radio en la ciudad alemana de Halle.
Ahora sabemos que el gas radiactivo observado por los Curie y Ernst Dorn era el Radón-222 mientras que el gas detectado por Rutherford era el Radón-220 . En 1908, Robert Whytlaw-Gray y William Ramsay recogieron suficiente radón y determinaron sus propiedades en el University College de Londres .
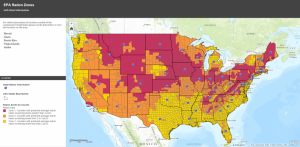
Mapa del gas radón de la Epa
Radón Identificación |
|||
| Número atómico | 86 | ||
| Número CAS | 10043-92-2 | Posición en la tabla periódica | Grupo | Periodo | Bloque | 6 | p |
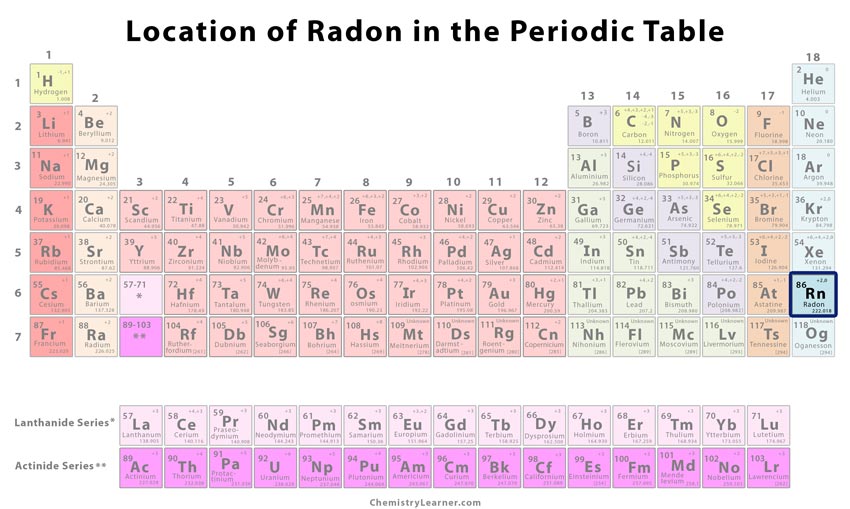
Ubicación del radón en la Tabla Periódica
Propiedades y características del radón
Propiedades generales |
|||||||||||||||||
| Masa atómica relativa masa atómica | |||||||||||||||||
| Masa atómica | amu | Masa molecular | 210.9906010 ± 0.0000070 g/mol | ||||||||||||||
Propiedades físicas |
|||||||||||||||||
| Color | Incoloro | ||||||||||||||||
| Punto de fusión/punto de congelación | -.71 °C, -96 °F | ||||||||||||||||
| Punto de ebullición | -61.7 °C, -79.1 °F | ||||||||||||||||
| Densidad | 0.009074 g cm-3 | ||||||||||||||||
| Estado de la materia a temperatura ambiente (sólido/líquido/gas) | Gas | Carga | Desconocida | ||||||||||||||
| Conductividad térmica | 0.00361 W/(m K) | ||||||||||||||||
| Inflamabilidad | No inflamable | ||||||||||||||||
| Calor específico | 94 J kg-1 K-1 | ||||||||||||||||
| Módulo de masa | Desconocido | ||||||||||||||||
| Módulo de cizallamiento | Desconocido | ||||||||||||||||
| Módulo de Young | Desconocido | ||||||||||||||||
| Presión de vapor | |||||||||||||||||
| – Temperatura (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | – Presión (Pa) | – | – | – | – | – | – | – | – | – | – | – |
Propiedades químicas Propiedades |
|||||||||||||||||
| Estados de oxidación | 2 | ||||||||||||||||
| Isótopos | Isótopo | Masa | Abundancia (%) | Mediavida | Modo de descomposición | ||||||||||||
| 211Rn | 210.991 | – | 14.6 h | β+, EC | |||||||||||||
| – | α | ||||||||||||||||
| 220Rn | 220.011 | – | 55.6 s | α | 222Rn | 128.905 | – | 3.823 d | α | ||||||||
Datos atómicos del radón (elemento 86)
| Electrones de valencia | ||||||||
| Números cuánticos | ||||||||
| – n | ||||||||
| – ℓ | 1 | |||||||
| – mℓ | 1 | |||||||
| – ms | -1/2 | Configuración de electrones (configuración de gases nobles) | 4f145d106s26p6 | Estructura atómica | ||||
| – Número de electrones | – Número de neutrones | 136 | ||||||
| – Número de protones | 86 | |||||||
| -Radio del átomo | ||||||||
| – Radio atómico | 2.20 Å | – Radio covalente | 1.46 Å | |||||
| Electronegatividad (Pauling- | Desconocida | |||||||
| Afinidad de los electrones | No estable | |||||||
| Energía de ionización (kJ mol-1) | 1º | 2º | 3º | 4º | 5º | 6º | 7º | 8º | 1037.073 | – | – | – | – | – | – | – |
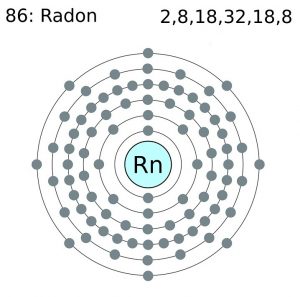
El electrón de radón Configuración (Modelo de Bohr)
Para qué se utiliza
- La descomposición radiactiva del radón es útil para obtener polonio .
- El radón emitido por una fuente de radio puede utilizarse en la terapia del cáncer . Se utilizaba habitualmente en los hospitales para el tratamiento de tumores mediante la implantación de diminutos tubos en los que se sellaba el gas . Hoy en día, se ha sustituido por opciones de tratamiento más seguras.
- Los kits de pruebas de radón se utilizan para analizar los niveles de radón en interiores en lugares donde se pueden acumular grandes concentraciones de gas radón en el interior . Si el resultado de la prueba muestra que el nivel es de 4 pCi/L o más, se utilizan sistemas de mitigación para reducir las concentraciones de radón.
- Los investigadores utilizan la concentración de radón en el suelo para trazar un mapa de las fallas geológicas del subsuelo, ya que las concentraciones suelen aumentar sobre las fallas . Las concentraciones de radón en las aguas subterráneas también se analizan para la predicción de terremotos.
- Es el gas químicamente inactivo más pesado conocido que puede formar compuestos con otras sustancias sólo en condiciones extremas .
- Se representa gráficamente con una imagen del símbolo de peligro de radiación con imágenes de fondo de casas que indican que el gas puede acumularse en las casas .
Toxicidad del radón y efectos sobre la salud
Los productos de desintegración del radón se han considerado cancerígenos . Dado que puede ser inhalado, las personas expuestas a altos niveles de radón corren el riesgo de desarrollar cáncer de pulmón . Las posibilidades de padecer cáncer de pulmón son mucho mayores en los fumadores expuestos al radón. Se cree que ha jugado un papel en la evolución y podría ser responsable de la radiación de fondo de la Tierra que puede causar modificaciones genéticas.
Hechos interesantes
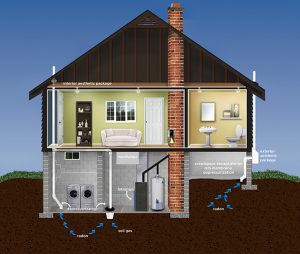
Sistema de mitigación del radón
Coste del radón
El precio del gas radón es de unos 4 dólares por m .
- http://www.rsc.org/periodic-table/element/86/radon
- https://education.jlab.org/itselemental/ele086.html
- http://www.chemistryexplained.com/elements/P-T/Radon.html
- https://www.livescience.com/39546-radon.html
- https://education.jlab.org/itselemental/iso086.html
- https://www.webqc.org/molecular-weight-of-radon.html
- https://www.chemicool.com/elements/radon.html
- http://www.cabrillo.edu/~aromero/Common%20Files/Periodic%20Table%20(Common%20Ionic%20Charges).pdf
- http://periodictable.com/Elements/086/data.html
- https://www.atsdr.cdc.gov/toxprofiles/tp145-c4.pdf
- http://chemistry-reference.com/q_elements.asp?Symbol=Rn&language=en
- https://sosradon.org/mitigation
- http://www.ipgp.fr/~klinger/page_web/biblio/publication/Richon_RadMeas2010%20.pdf
- .
- https://www.jstage.jst.go.jp/article/jpe1952/43/5/43_5_585/_pdf
- https://www.epa.gov/radon/health-risk-radon
- https://hobart.k12.in.us/ksms/PeriodicTable/radon.htm