Chemistry Learner
Che cos’e’ il Radon
Radon (pronuncia: RAY-don) e’ un elemento inodore e radioattivo che appartiene alla famiglia dei gas nobili ed e’ rappresentato dal simbolo chimico Rn . È incolore a temperatura ambiente, ma diventa fosforescente quando viene raffreddato al di sotto della sua temperatura di congelamento e si trasforma gradualmente in rosso-arancio quando la temperatura viene ulteriormente abbassata al punto di ebollizione dell’aria liquida.

Simbolo del radon
Isotopi
Ci sono più di 35 isotopi radioattivi del radon, che vanno da 195Rn-229Rn, di cui 222Rn è il più stabile con un periodo di emivita di 3.823 giorni e forma 218Po attraverso il decadimento α. Ha quattro isotopi presenti in natura, tra cui 218Rn, 219Rn, 220Rn e 222Rn.
Dove si trova il radon
Il radon si trova sempre in natura perché è prodotto dalla decomposizione radioattiva del radio-226 che è presente nelle rocce fosfatiche, nei minerali di uranio, nelle rocce metamorfiche e nelle rocce comuni come il calcare. Una piccola quantità di radon si trova anche nell’atmosfera.

Radon Test Kit
Storia
Origine del suo nome: Prende il nome dall’elemento metallico radioattivo radio, perché il radon è stato identificato per la prima volta durante il decadimento radioattivo del radio.
Chi l’ha scoperto: Il fisico tedesco Friedrich Ernst Dorn è noto per la sua scoperta.
Quando e come fu scoperto
Nel 1899, Robert B. Owens e Ernest Rutherford trovarono un gas radioattivo emanato dal torio. Nello stesso anno, Marie e Pierre Curie rilevarono un gas rilasciato dal radio. Nel 1900, Ernst Dorn scoprì un gas mentre studiava la catena di decadimento del radio nella città tedesca di Halle.
Oggi sappiamo che il gas radioattivo osservato dai Curie e da Ernst Dorn era Radon-222 mentre il gas rilevato da Rutherford era Radon-220. Nel 1908, Robert Whytlaw-Gray e William Ramsay hanno raccolto abbastanza radon e determinato le proprietà del radon all’University College di Londra.
Mappa del gas radon dell’Epa
Identificazione del radon Identificazione |
|||
| Numero atomico | 86 | ||
| Numero CAS | 10043-92-2 | ||
| Posizione nella tavola periodica | Gruppo | Periodo | Blocco |
| 18 | 6 | p | |
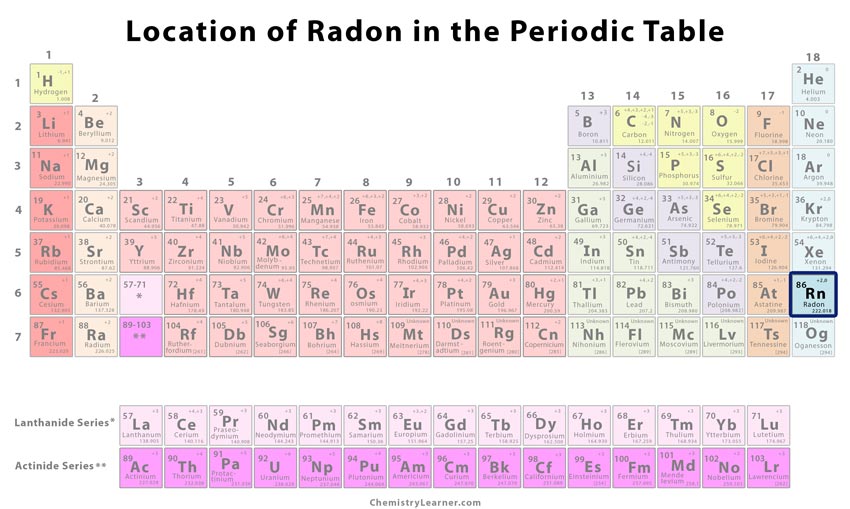
Posizione del radon sulla tavola periodica
Proprietà e caratteristiche del radon
Proprietà generali |
||||||||||||||||
| Massa atomica relativa massa atomica | ||||||||||||||||
| Massa atomica | amu | |||||||||||||||
| Massa molecolare | 210.9906010 ± 0.0000070 g/mol | |||||||||||||||
Proprietà fisiche |
||||||||||||||||
| Colore | Incolore | |||||||||||||||
| Punto di fusione/punto di congelamento | -71 °C, -96 °F | |||||||||||||||
| Punto di ebollizione | -61.7 °C, -79.1 °F | |||||||||||||||
| Densità | 0.009074 g cm-3 | |||||||||||||||
| Stato della materia a temperatura ambiente (solido/liquido/gas) | Gas | |||||||||||||||
| Carica | Sconosciuto | |||||||||||||||
| Conducibilità termica (calore) | 0.00361 W/(m K) | |||||||||||||||
| Infiammabilità | Non infiammabile | |||||||||||||||
| Calore specifico | 94 J kg-1 K-1 | |||||||||||||||
| Modulo di massa | Sconosciuto | |||||||||||||||
| Modulo di taglio | Sconosciuto | |||||||||||||||
| Modulo di Young | Sconosciuto | |||||||||||||||
| Pressione di vapore | ||||||||||||||||
| – Temperatura (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Pressione (Pa) | – | – | – | – | – | – | – | – | – | – | – | |||||
Proprietà chimiche Proprietà |
||||||||||||||||
| Stati di ossidazione | 2 | |||||||||||||||
| Isotopi | Isotopo | Massa | Abbondanza (%) | Massavita | Modo di decadimento | |||||||||||
| 211Rn | 210.991 | – | 14.6 h | β+, EC | ||||||||||||
| – | α | |||||||||||||||
| 220Rn | 220.011 | – | 55.6 s | α | ||||||||||||
| 222Rn | 128.905 | – | 3.823 d | α | ||||||||||||
Dati atomici del radon (elemento 86)
| Elettroni di valenza | 8 | |||||||
| Numeri quantici | ||||||||
| – n | 6 | |||||||
| – ℓ | 1 | |||||||
| – mℓ | 1 | |||||||
| – ms | -1/2 | |||||||
| Configurazione degli elettroni (configurazione dei gas nobili) | 4f145d106s26p6 | |||||||
| Struttura atomica | ||||||||
| – Numero di elettroni | 86 | |||||||
| – Numero di neutroni | 136 | |||||||
| – Numero di protoni | 86 | |||||||
| Raggio dell’atomo | ||||||||
| – Raggio atomico | 2.20 Å | |||||||
| – Raggio covalente | 1.46 Å | |||||||
| Elettronegatività (Pauling-scala) | Sconosciuto | |||||||
| Affinità degli elettroni | Non stabile | |||||||
| Energia di ionizzazione (kJ mol-1) | 1° | 2° | 3° | 4° | 5° | 6° | 7° | 8° |
| 1037.073 | – | – | – | – | – | – | – | |
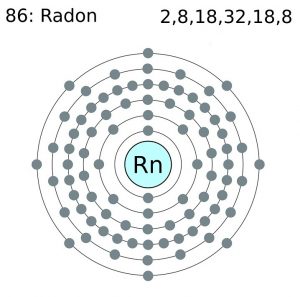
Configurazione dell’elettrone radon Configurazione (Modello Bohr)
A cosa serve
- La decomposizione radioattiva del radon è utile per ottenere il polonio.
- Il radon emesso da una sorgente di radio può essere usato nella terapia del cancro. Era comunemente usato negli ospedali per il trattamento dei tumori attraverso l’impianto di piccoli tubi in cui il gas era sigillato. Oggi, è stato sostituito da opzioni di trattamento più sicure.
- I kit di test del radon sono utilizzati per analizzare i livelli di radon indoor in luoghi dove grandi concentrazioni di gas radon possono accumularsi in casa. Se il risultato del test mostra che il livello è di 4 pCi/L o più, i sistemi di mitigazione sono utilizzati per ridurre le concentrazioni di radon.
- I ricercatori utilizzano la concentrazione di radon nel suolo per mappare le faglie geologiche del sottosuolo, poiché le concentrazioni generalmente aumentano sopra le faglie. Le concentrazioni di radon nelle acque sotterranee sono anche analizzate per la previsione dei terremoti.
Tossicità del radon ed effetti sulla salute
I prodotti di decadimento del radon sono stati considerati come cancerogeni. Poiché può essere inalato, le persone esposte ad alti livelli di radon sono a rischio di sviluppare il cancro ai polmoni. Le probabilità di essere colpiti dal cancro ai polmoni sono molto più alte nei fumatori che sono esposti al radon. Si pensa che abbia avuto un ruolo nell’evoluzione e potrebbe essere responsabile della radiazione di fondo della Terra che può causare modifiche genetiche.
Fatti interessanti
- È il più pesante gas chimicamente inattivo conosciuto che può formare composti con altre sostanze solo in condizioni estreme.
- E’ rappresentato graficamente da un’immagine del simbolo del pericolo di radiazioni con immagini di sfondo di case che indicano che il gas può accumularsi nelle case.
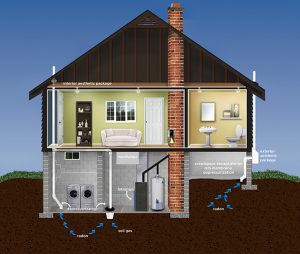
Sistema di mitigazione del radon
Costo del radon
Il prezzo del gas radon è di circa 4 dollari al m .
- http://www.rsc.org/periodic-table/element/86/radon
- https://education.jlab.org/itselemental/ele086.html
- http://www.chemistryexplained.com/elements/P-T/Radon.html
- https://www.livescience.com/39546-radon.html
- https://education.jlab.org/itselemental/iso086.html
- https://www.webqc.org/molecular-weight-of-radon.html
- https://www.chemicool.com/elements/radon.html
- http://www.cabrillo.edu/~aromero/Common%20Files/Periodic%20Table%20(Common%20Ionic%20Charge).pdf
- http://periodictable.com/Elements/086/data.html
- https://www.atsdr.cdc.gov/toxprofiles/tp145-c4.pdf
- http://chemistry-reference.com/q_elements.asp?Symbol=Rn&language=en
- https://sosradon.org/mitigation
- http://www.ipgp.fr/~klinger/page_web/biblio/publication/Richon_RadMeas2010%20.pdf
- https://www.jstage.jst.go.jp/article/jpe1952/43/5/43_5_585/_pdf
- https://www.epa.gov/radon/health-risk-radon
- https://hobart.k12.in.us/ksms/PeriodicTable/radon.htm