Hipertensión inducida por medicamentos
US Pharm. 2008;33(9):HS11-HS20.
Los farmacéuticos reciben a menudo consultas sobre los efectos de los medicamentos en la presión arterial. Por ejemplo, la preocupación por los productos de venta libre para la tos y el resfriado sigue surgiendo a pesar de que algunos ingredientes, como la fenilpropanolamina, han sido retirados del mercado estadounidense. Aunque sólo unas pocas clases de fármacos causan aumentos clínicamente significativos de la presión arterial, los farmacéuticos deben ser conscientes de los fármacos que pueden interferir en el control eficaz de la presión arterial. Una revisión de las interacciones farmacológicas con los agentes antihipertensivos va más allá del alcance de este artículo. Sin embargo, se discutirán algunos de los ejemplos más comunes de hipertensión inducida por fármacos (TABLA 1). Las elevaciones de la presión arterial inducidas por fármacos representan una causa importante y modificable de hipertensión secundaria; por lo tanto, es imperativo que los farmacéuticos reconozcan esta relación causal.
Agentes simpaticomiméticos
Está bien establecido que las aminas simpaticomiméticas causan aumentos de la presión arterial relacionados con la dosis.1-4 Aunque la hipertensión inducida por simpaticomiméticos puede no ser clínicamente significativa en pacientes sanos, puede llegar a ser peligrosa en otros.1-4 Las aminas simpaticomiméticas incluyen las anfetaminas y compuestos similares, como la pseudoefedrina, la fenilpropanolamina y la efedrina. Históricamente, estos compuestos estaban presentes en algunos preparados de venta libre para la tos y el resfriado. Debido a que el uso de la fenilpropanolamina se correlacionó con la hipertensión y los accidentes cerebrovasculares, la FDA la prohibió del mercado en noviembre de 2000.3,4
Pseudoefedrina: La pseudoefedrina es un broncodilatador y vasoconstrictor nasal que suele ser inocuo cuando se utiliza en las dosis recomendadas. Sin embargo, debido a su potencial de uso indebido, muchos minoristas restringen su venta al mostrador. La pseudoefedrina se utiliza habitualmente para tratar los síntomas de la rinitis y la rinorrea, pero sus efectos sobre la presión arterial y la frecuencia cardíaca siguen siendo inciertos. Debido a su similitud farmacológica con la efedrina y la fenilpropanolamina, también se ha evitado el uso de la pseudoefedrina en pacientes hipertensos.
Salerno y cols. evaluaron si la pseudoefedrina provoca elevaciones clínicamente significativas de la presión arterial y la frecuencia cardíaca.5 En este metanálisis, los datos primarios extraídos incluyeron la presión arterial sistólica y diastólica y la frecuencia cardíaca. Veinticuatro ensayos clínicos tenían información extraíble de los signos vitales e incluyeron un total de 1.285 pacientes. Este análisis demostró que la pseudoefedrina provoca un pequeño aumento medio de la presión arterial sistólica (aproximadamente 1 mmHg), sin efecto significativo sobre la presión arterial diastólica, y un ligero aumento de la frecuencia cardíaca (unos 3 latidos por minuto). Las formulaciones de liberación inmediata tuvieron un mayor efecto que las de liberación sostenida, lo que era de esperar en base a la farmacocinética. Entre las formulaciones de liberación inmediata, hubo un aumento relacionado con la dosis en las tres variables cardiovasculares. Se observaron aumentos más sustanciales de la presión arterial sistólica y diastólica con dosis crecientes de pseudoefedrina. Las mujeres parecían ser ligeramente menos susceptibles a los efectos cardiovasculares que los hombres. En los pacientes cuya hipertensión era estable y estaba controlada, el tratamiento con pseudoefedrina aumentó la presión arterial sistólica pero no tuvo ningún efecto sobre la presión diastólica. No hubo ningún efecto sobre la frecuencia cardíaca en los pacientes hipertensos tratados, aunque esto puede deberse a que muchos pacientes estaban recibiendo betabloqueantes. No se documentó ningún resultado adverso clínicamente significativo, como urgencias hipertensivas, accidentes cerebrovasculares o arritmias. Otros investigadores han concluido de forma similar que, cuando se utiliza en dosis estándar, la pseudoefedrina no tiene un efecto clínicamente significativo sobre la presión arterial sistólica o diastólica en pacientes con hipertensión controlada.6
Los farmacéuticos deben aconsejar a los pacientes que la pseudoefedrina puede aumentar modestamente la presión arterial y la frecuencia cardíaca. Estos efectos son mayores con las formulaciones de liberación inmediata, las dosis más altas y la administración de medicamentos a corto plazo. Los pacientes con hipertensión estable y controlada no parecen tener un mayor riesgo de elevación de la presión arterial en comparación con los que no tienen hipertensión. Sin embargo, no se puede predecir cómo reaccionará cada paciente. La relación riesgo-beneficio debe evaluarse cuidadosamente antes de utilizar cualquier agente simpaticomimético en personas con hipertensión. Los farmacéuticos deben instruir a los pacientes con enfermedades cardiovasculares para que controlen cuidadosamente su presión arterial después de empezar a tomar medicamentos que contengan pseudoefedrina. En general, se prefieren los productos de liberación sostenida para evitar aumentos de la presión arterial. Como alternativa, podrían utilizarse descongestionantes intranasales como la oximetazolina, ya que no se ha demostrado que induzcan a la hipertensión cuando se utilizan en las dosis recomendadas.7
Derivados de la anfetamina: Una variedad de fármacos utilizados para la narcolepsia y el trastorno por déficit de atención/hiperactividad están químicamente relacionados con la anfetamina. Estos estimulantes del sistema nervioso central (SNC) incluyen la dextroanfetamina, la metanfetamina y el metilfenidato. La FDA ha emitido recientemente una advertencia sobre la dextroanfetamina, afirmando que el uso del tratamiento con estimulantes del SNC a las dosis habituales en niños y adolescentes con problemas cardíacos graves y anomalías cardíacas estructurales se ha asociado con la muerte súbita.8 Sin embargo, los acontecimientos cardiovasculares adversos inducidos por los estimulantes no se limitan a los niños. Los adultos con enfermedades cardíacas conocidas también han mostrado un mayor riesgo de muerte súbita con el uso de estimulantes a dosis normales. Como norma general, los compuestos relacionados con las anfetaminas (es decir, los estimulantes del SNC) deben evitarse en pacientes con anomalías cardíacas estructurales graves conocidas, cardiomiopatía, anomalías graves del ritmo cardíaco u otros problemas cardíacos graves que aumenten el riesgo de muerte súbita. Se han observado aumentos tanto de la frecuencia cardíaca como de la presión arterial en niños que reciben fármacos de esta clase.9 Por lo tanto, este riesgo cardiovascular potencial debe sopesarse con los efectos beneficiosos para el comportamiento de estos medicamentos.
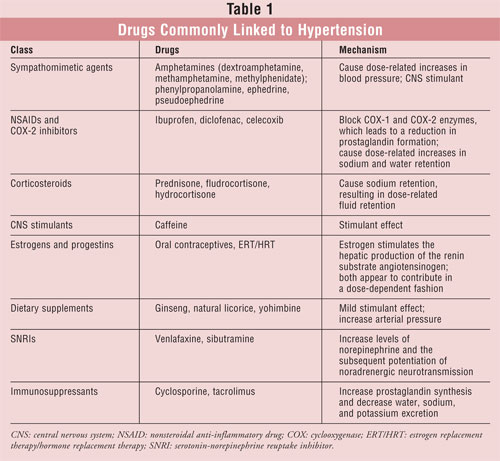
Los AINE y los inhibidores de la COX-2
Los antiinflamatorios no esteroideos (AINE) tienen efectos potencialmente adversos sobre la presión arterial.10,11 Los AINE bloquean las enzimas ciclooxigenasa-1 (COX-1) y COX-2, lo que conduce a una reducción de la formación de prostaglandinas. Estos fármacos pueden tener efectos beneficiosos y perjudiciales generalizados, dependiendo del contexto del paciente. La hipertensión inducida por fármacos asociada a los AINE se debe a los efectos renales de estos medicamentos. En concreto, los AINE provocan un aumento de la retención de sodio y agua relacionado con la dosis. Este efecto también se observa con los agentes selectivos de la COX-2, como el celecoxib.11
Las isoformas COX-1 y COX-2 se expresan en el riñón adulto normal, con la COX-1 en el glomérulo y la arteriola aferente y la COX-2 en la arteriola aferente, los podocitos y la mácula densa.12 La localización específica de cada una de estas isoenzimas en el riñón se traduce en efectos notablemente diferentes sobre la función renal. Las prostaglandinas producidas por la COX-1 afectan principalmente a la homeostasis renal al promover la vasodilatación en el lecho vascular renal, reduciendo la resistencia vascular renal y, por consiguiente, aumentando la perfusión renal. Las prostaglandinas producidas por la isoenzima COX-2 tienen efectos diuréticos y natriuréticos.12,13 En los pacientes con compromiso hemodinámico, los efectos de las dos isoenzimas son esenciales para el mantenimiento de la perfusión renal debido a sus efectos vasodilatadores. Dado que los AINEs bloquean la producción de las prostaglandinas COX-1 y COX-2, los efectos secundarios renales no son infrecuentes, y se producen en aproximadamente el 1% al 5% de los usuarios de AINEs.13
Al inhibir el efecto natriurético de la COX-2, aumentando así la retención de sodio, todos los AINEs conllevan el consiguiente riesgo de aumentar la retención de líquidos.14 Además, la inhibición de las prostaglandinas vasodilatadoras y la producción de factores vasoconstrictores, concretamente la endotelina-1, pueden contribuir a la inducción de la hipertensión en un paciente normotenso y/o hipertenso controlado.14
En una comparación de celecoxib con diclofenaco realizada en 287 pacientes con artritis, se observaron efectos secundarios cardiovasculares y renales en 79 pacientes (27,8%), siendo la hipertensión la más común (16,6%).14 No hubo diferencias estadísticas en la incidencia de hipertensión entre los grupos de AINE tradicionales y de COX-2. Este inicio de la hipertensión por parte de los AINE es especialmente importante en el debate sobre la seguridad de la COX-2 a la luz del hecho de que el estado de hipertensión es un factor de riesgo clave en la progresión de prácticamente todas las enfermedades cardiovasculares, incluidos el ictus, el infarto de miocardio y la insuficiencia cardíaca congestiva.15
Se ha publicado un reciente metaanálisis de los inhibidores de la COX-2 y sus efectos sobre la presión arterial.16 Se recogieron datos de 45.451 pacientes de 19 ensayos clínicos. Curiosamente, parecía haber una elevación de la presión arterial algo mayor con los inhibidores de la COX-2 en comparación con el placebo y los AINE no selectivos (por ejemplo, ibuprofeno y diclofenaco). El rofecoxib pareció conferir un mayor riesgo de desarrollar elevaciones clínicamente importantes de la presión sistólica y diastólica en comparación con el celecoxib. Sin embargo, el rofecoxib se retiró voluntariamente del mercado en 2004 debido a la preocupación por el aumento del riesgo de infarto de miocardio e ictus.17
Debido a la amplia disponibilidad de los AINE sin receta, muchos pacientes con hipertensión pueden correr el riesgo de que se agraven los efectos de la presión arterial causados por estos fármacos. Los farmacéuticos deben realizar un cuidadoso historial de medicación y preguntar específicamente sobre el uso de AINE sin receta. Los pacientes con hipertensión deben ser vigilados más estrechamente para detectar elevaciones de la presión arterial cuando utilizan AINE. Se debe aconsejar a los pacientes que este efecto adverso tiende a estar relacionado con la dosis, pero no siempre es predecible. El efecto adverso de todos los AINE y de los inhibidores de la COX-2 sobre la presión arterial puede tener la mayor importancia clínica en los ancianos, en los que la prevalencia de la artritis, la hipertensión y el uso de AINE es alta.18
Corticoesteroides
Todos los fármacos corticoesteroides, incluida la prednisona, pueden causar retención de sodio, dando lugar a una retención de líquidos relacionada con la dosis.19 Los corticoesteroides con fuertes efectos mineralocorticoides, como la fludrocortisona y la hidrocortisona, producen la mayor cantidad de retención de líquidos. Sin embargo, algunos corticosteroides que carecen de una actividad mineralocorticoide significativa (por ejemplo, la dexametasona, la triamcinolona, la betametasona) pueden producir una retención de líquidos menor.20 La retención de líquidos inducida por los corticosteroides puede ser lo suficientemente grave como para causar hipertensión, y los pacientes con hipertensión preexistente pueden desarrollar un empeoramiento del control de la presión arterial cuando se inician estos fármacos. El principal mecanismo de la hipertensión inducida por corticosteroides es la sobreestimulación del receptor de mineralocorticoides, lo que provoca la retención de sodio en el riñón. Esto da lugar a una expansión del volumen y al consiguiente aumento de la presión arterial. La hipertensión inducida por corticosteroides puede responder al tratamiento con diuréticos.21 Se debe utilizar la dosis efectiva más pequeña y la duración más corta del tratamiento con esteroides para disminuir el desarrollo de este efecto adverso.
La fludocortisona provoca aumentos significativos de la presión arterial y, por tanto, es útil en el tratamiento de pacientes con hipotensión postural. En un estudio de 64 pacientes de edad avanzada que recibieron una dosis media de 75 mcg de fludrocortisona durante aproximadamente cinco meses, cuatro pacientes tuvieron que retirarse debido a la hipertensión inducida por el fármaco.22 Los investigadores del estudio concluyeron que el tratamiento con fludrocortisona era mal tolerado en los pacientes de edad avanzada, incluso a dosis bajas.
Cafeína
Los efectos de la cafeína sobre el control de la presión arterial no están bien definidos. Recientemente se ha publicado un meta-análisis de ensayos controlados aleatorios que analizan el efecto del café o de la cafeína sola sobre los niveles de presión arterial.23 Se seleccionaron para su revisión un total de 16 estudios con diseños aleatorios y controlados, que representaban a 1.010 sujetos. Después de agrupar estos ensayos, se encontró un aumento de 2,04 mmHg en la presión arterial sistólica y de 0,73 mmHg en la presión arterial diastólica. Cuando se analizaron por separado los ensayos con café y cafeína, las elevaciones de la presión arterial inducidas fueron mayores con la cafeína (410 mg/día) que con el café (725 ml/día). Los efectos del café y la cafeína sobre la frecuencia cardíaca no fueron significativos.
Estrógenos y progestágenos
El uso crónico de anticonceptivos orales puede elevar ligeramente la presión arterial en ciertas mujeres y puede tener otros efectos adversos sobre el riesgo cardiovascular. En los primeros estudios epidemiológicos en los que se utilizaron dosis elevadas de estrógenos se encontraron elevaciones medias de la presión arterial de 3 a 6 mmHg sistólica y de 2 a 5 mmHg diastólica, y aproximadamente el 5% de las mujeres desarrollaron una nueva hipertensión.24 Esto era más probable que ocurriera en pacientes que habían desarrollado previamente hipertensión durante un embarazo o en aquellas con antecedentes familiares de hipertensión. Aunque el aumento de la presión arterial suele ser leve, puede producirse una hipertensión maligna.25 La principal preocupación que suscita el aumento de la presión arterial inducido por los anticonceptivos orales es el desarrollo de una hipertensión persistente y la posterior enfermedad cardiovascular prematura, especialmente en las mujeres que fuman. La interrupción del tratamiento suele conducir a una vuelta a la presión arterial inicial en un plazo de dos a 12 meses, pero puede persistir la proteinuria.25,26
Los mecanismos responsables del efecto hipertensivo de los anticonceptivos orales no se conocen bien. El sistema renina-angiotensina puede estar implicado, ya que los estrógenos estimulan la producción hepática del sustrato de la renina, el angiotensinógeno.27 Tanto los estrógenos como la progesterona parecen contribuir de forma dependiente de la dosis. La incidencia del 5% de la hipertensión asociada a los estrógenos, citada a menudo, se deriva de estudios de terapias de alta dosis en las que la dosis de estrógenos era de al menos 50 mcg y la de progestágenos de 1 a 4 mg.24 Sin embargo, los preparados actuales contienen tan sólo un 20% de la cantidad de estrógenos y progestágenos utilizados en los preparados anteriores. Un informe del Nurses’ Health Study (Estudio de Salud de las Enfermeras) evaluó prospectivamente a casi 70.000 enfermeras de entre 25 y 42 años.28 Después de ajustar por edad, peso, tabaquismo, antecedentes familiares y otros factores de riesgo, el riesgo relativo de hipertensión en las enfermeras, en comparación con las mujeres que nunca usaron anticonceptivos orales, fue de 1,8 para las usuarias actuales y de 1,2 para las usuarias anteriores. En general, sólo 41,5 casos de hipertensión por cada 10.000 personas-año podían atribuirse al uso de anticonceptivos orales, y esta cifra disminuía rápidamente con el cese de la terapia. En un metaanálisis de 14 estudios publicados entre 1980 y 2003, el riesgo relativo de accidente cerebrovascular y ataque cardíaco se multiplicó por dos en las usuarias actuales de anticonceptivos orales (<50 mcg de etinilestradiol al día).29
La terapia de sustitución de estrógenos (TRE) posmenopáusica, o la terapia de sustitución hormonal (TRH) cuando se combina con progestágenos, consiste en dosis de estrógenos mucho más bajas que las de los anticonceptivos orales. La TRE y la TRH parecen tener un efecto neutro sobre la presión arterial, como ilustran las siguientes observaciones de dos grandes ensayos aleatorios. El Women’s Health Initiative (WHI) es el mayor (N = 16.000) ensayo aleatorizado y controlado con placebo que ha evaluado el efecto del reemplazo de estrógeno-progestina en los resultados de las mujeres posmenopáusicas.30 A los 5,2 años, la THS produjo sólo un pequeño aumento (1,5 mmHg) de la presión sistólica en comparación con el placebo. Se observaron resultados similares en el ensayo PEPI, en el que la TRE, con o sin progestágenos, no afectó a la presión arterial a los tres años.31
Estudios adicionales en los que participaron menos mujeres han encontrado una reducción de la presión arterial ambulatoria y un mayor descenso de la presión nocturna en las usuarias de la TRE.32,33 Es posible que la TRE pueda ralentizar el aumento de la presión sistólica durante un periodo de tratamiento más largo.34 Sin embargo, debido a los aumentos significativos del riesgo coronario, de ictus y de tromboembolismo venoso demostrados en el WHI, la THS ya no se recomienda para la protección cardiovascular.35
Suplementos dietéticos
El ginseng está generalmente reconocido como seguro y se ha asociado con pocos efectos secundarios graves. Debido a que puede tener un efecto estimulante leve, debe advertirse su uso con otros estimulantes en pacientes con enfermedades cardiovasculares. Se ha descrito un tipo de síndrome de abuso del ginseng, caracterizado por diarrea, hipertensión, nerviosismo, erupciones dermatológicas e insomnio.36 Este síndrome puede presentarse después de dosis altas únicas o de períodos prolongados de uso. Otros suplementos que pueden aumentar la presión arterial son el regaliz natural y la yohimbina.37 En general, todos los pacientes con hipertensión deben consultar previamente el uso de suplementos dietéticos con su farmacéutico o médico. Los efectos de la mayoría de los suplementos sobre la presión arterial no se han caracterizado adecuadamente.
Inhibidores de la recaptación de serotonina-norepinefrina
Venlafaxina: Venlafaxina es un inhibidor de la recaptación de serotonina-norepinefrina (IRSN) utilizado en el tratamiento de la depresión y los trastornos de ansiedad. El mecanismo probable de la hipertensión inducida por venlafaxina es el aumento de los niveles de norepinefrina y la subsiguiente potenciación de la neurotransmisión noradrenérgica.38 La formulación de liberación prolongada de venlafaxina aumenta la presión arterial en aproximadamente el 3% de los pacientes cuando se utilizan dosis normales (75-150 mg).38 Sin embargo, la mayoría de estas elevaciones de la presión arterial se consideraron menores. Las dosis >=300 mg de venlafaxina de liberación prolongada demostraron elevaciones clínicamente significativas en el 13% de los pacientes, con la mayoría de los aumentos de la presión arterial entre 10 y 15 mmHg.39 Sin embargo, es importante tener en cuenta que las dosis de 300 mg o más no son comunes, y el riesgo de hipertensión inducida por la venlafaxina no suele justificar la interrupción de este fármaco.40
Sibutramina: La importancia clínica de la hipertensión inducida por la sibutramina no está bien definida. La sibutramina es un IRSN y es químicamente similar a la anfetamina. El mecanismo probable de elevación de la presión arterial de la sibutramina, tanto en pacientes normotensos como hipertensos, es la elevada cantidad de norepinefrina presente en el organismo.41 Un ensayo clínico que evaluó las reacciones adversas inducidas por la sibutramina demostró una elevación media de la presión arterial sistólica y diastólica de 2 mmHg en pacientes previamente normotensos que recibían de 10 a 15 mg de sibutramina al día. Curiosamente, se demostró una elevación de 7 mmHg en pacientes hipertensos que recibían dosis similares.42 Otros ensayos han demostrado resultados similares.43,44 Los pacientes con hipertensión establecida que recibían sibutramina experimentaban elevaciones de la presión arterial significativamente mayores que los pacientes que tenían una presión arterial normal antes de iniciar la medicación. El tratamiento con sibutramina debe limitarse probablemente a los pacientes que no tengan enfermedades cardiovasculares, incluyendo hipertensión, anomalías funcionales y enfermedad arterial coronaria.
Inmunosupresores
Ciclosporina: El efecto adverso de la ciclosporina sobre la presión arterial es bien conocido.45 El mecanismo exacto de la hipertensión inducida por la ciclosporina es incierto, pero se han propuesto varias hipótesis, como el aumento de la síntesis de prostaglandinas y la disminución de la excreción de agua, sodio y potasio.46,47 Hasta el 50% de los pacientes con trasplante renal que reciben tratamiento con ciclosporina han notificado una elevación de la presión arterial, y la mayoría de estos casos requirieron tratamiento para la hipertensión.48 Debido a los efectos adversos de la retirada de la ciclosporina en los pacientes trasplantados y en los pacientes con enfermedades autoinmunes, rara vez se suspende la ciclosporina por hipertensión elevada. El tratamiento de la hipertensión inducida por la ciclosporina puede ser farmacológico, consistente posiblemente en bloqueadores de los canales de calcio, diuréticos, betabloqueantes o inhibidores de la ECA, o no farmacológico, consistente en la reducción de la ingesta de sodio.45 En 1999, se publicó una declaración de consenso en la que se establecía que si la presión arterial sistólica se elevaba por encima de 140 mmHg o la presión diastólica se elevaba por encima de 90 mmHg en dos ocasiones consecutivas, la dosis de ciclosporina debía reducirse en un 25%.48 La presión arterial debe controlarse cada dos semanas durante los tres primeros meses de tratamiento con ciclosporina para vigilar cualquier cambio.
Tacrolimus: En los pacientes con hipertensión grave, refractaria al tratamiento con ciclosporina, el cambio a tacrolimus puede ser una opción. El tacrolimus, al igual que la ciclosporina, ha demostrado tener un efecto significativo sobre la presión arterial. Sin embargo, la incidencia de la hipertensión inducida por el tacrolimus (35%) es menor que la de la ciclosporina (50%).49 Se postula que el mecanismo de la hipertensión inducida por el tacrolimus es similar al de la ciclosporina, como se ha comentado anteriormente.50 Pueden ser necesarias modificaciones similares a las enumeradas para la hipertensión inducida por la ciclosporina, ya sean farmacológicas o no farmacológicas, para tratar las elevaciones de la presión arterial asociadas al tratamiento con tacrolimus.51 Se justifica una cuidadosa monitorización de la presión arterial durante el tratamiento con tacrolimus o ciclosporina.
Resumen
Los farmacéuticos deben mantener un conocimiento de las principales clases de fármacos que pueden aumentar la presión arterial y/o interferir con el control eficaz de la presión arterial. Algunos ejemplos son los simpaticomiméticos, los AINE, los estrógenos, los corticosteroides, la ciclosporina y algunos productos naturales (por ejemplo, el ginseng). Los farmacéuticos deben detectar los medicamentos que aumentan la presión arterial y deben proporcionar información a los pacientes y a los proveedores de servicios médicos para disminuir esta causa potencial de hipertensión secundaria. En general, todos los pacientes con hipertensión deben ser controlados más estrechamente cada vez que se prescriben medicamentos adicionales, especialmente cuando se añaden fármacos conocidos por elevar la presión arterial.
1. Cantu C, Arauz A, Murillo-Bonilla LM, et al. Ictus asociado a los simpaticomiméticos contenidos en los medicamentos de venta libre para la tos y el resfriado. Stroke. 2003;34:1667-1672.
2. Kernan W, Viscoli C, Brass L, et al. Phenylpropanolamine and the risk of hemorrhagic stroke. N Engl J Med. 2000;343:1826-1832.
3. Fleming GA. La FDA, la regulación y el riesgo de ictus. N Engl J Med. 2000;343:1886-1887.
4. Mersfelder TL. Phenylpropanolamine and stroke: the study, the FDA ruling, the implications. Cleveland Clin J Med. 2001;68:213-219.
5. Salerno SM, Jackson JL, Berbano EP. Efecto de la pseudoefedrina oral sobre la presión arterial y la frecuencia cardíaca: un meta-análisis. Arch Intern Med. 2005;165:1686-1694.
6. Coates ML, Rembold CM, Farr BM. ¿Aumenta la pseudoefedrina la presión arterial en pacientes con hipertensión controlada? J Fam Pract. 1995;40:22-26.
7. Bradley JG. Medicamentos de venta libre e hipertensión. ¿Cuáles afectan a la presión arterial? Postgrad Med.1991;89:195-197,201-202.
8. Alertas de seguridad de 2006 para medicamentos, productos biológicos, dispositivos médicos y suplementos dietéticos. Dexedrine (sulfato de dextroanfetamina). FDA. 21 de agosto de 2006. www.fda.gov/medwatch/safety/2006/safety06.htm#Dexedrine. Consultado el 13 de mayo de 2008.
9. Samuels JA, Franco K, Wan F, Sorof JM. Effect of stimulants on 24-h ambulatory blood pressure in children with ADHD: a double-blind, randomized, cross-over trial. Pediatr Nephrol. 2006;21:92-95.
10. Howard PA, Delafontaine P. Nonsteroidal anti-inflammatory drugs and cardiovascular risk. J Am Coll Cardiol. 2004;43:519-525.
11. Armstrong EP, Malone DC. The impact of nonsteroidal anti-inflammatory drugs on blood pressure, with an emphasis on newer agents. Clin Ther. 2003;25:1-18.
12. Schnitzer TJ. Inhibidores específicos de la ciclooxigenasa 2: ¿son seguros? Am J Med. 2001;110:46S-49S.
13. DeMaria AN, Weir MR. Coxibs–más allá del tracto gastrointestinal: cuestiones renales y cardiovasculares. J Pain Symptom Manage. 2003;25(suppl 2):S41-S49.
14. Stollberger C, Finsterer J. Side effects of conventional nonsteroidal anti-inflammatory drugs and celecoxib: more similarities than differences. South Med J. 2004;97:209.
15. Fitzgerald GA. Coxibs y enfermedad cardiovascular. N Eng J Med. 2004;351:1709-1711.
16. Aw TJ, Haas SJ, Liew D, Krum H. Meta-analysis of COX-2 inhibitors and their effects on blood pressure. Arch Intern Med. 2005;165:490-496.
17. Merck anuncia la retirada voluntaria a nivel mundial de VIOXX. 30 de septiembre de 2004. www.merck.com/newsroom/vioxx/pdf/vioxx_press_release_final.pdf. Consultado el 13 de mayo de 2008.
18. de Leeuw PW. Drug-induced hypertension. Recognition and management in older patients. Drugs Aging. 1997;11:178-185.
19. Clyburn EB, DiPette DJ. Hipertensión inducida por fármacos y otras sustancias. Semin Nephrol. 1995;15:72-86.
20. Hari P, Bagga A, Mantan M. Short term efficacy of intravenous dexamethasone and methylprednisolone therapy in steroid resistant nephrotic syndrome. Indian Pediatr. 2004;41:993-1000.
21. Ferrari P. Cortisol and the renal handling of electrolytes: role in glucocorticoid-induced hypertension and bone disease. Best Pract Res Clin Endocrinol Metab. 2003;17:575-589.
22. Hussain RM, McIntosh SJ, Lawson J, et al. Fludrocortisone in the treatment of hypotensive disorders in the elderly. Heart. 1996;76:507-509.
23. Noordzij M, Uiterwaal CS, Arends LR, et al. Respuesta de la presión arterial a la ingesta crónica de café y cafeína: un metaanálisis de ensayos controlados aleatorios. J Hypertens. 2005;23:921-928.
24. Woods JW. Anticonceptivos orales e hipertensión. Hypertension. 1988;11:II11-II15.
25. Lim KG, Isles CG, Hodsman GP. Malignant hypertension in women of childbearing age and its relation to the contraceptive pill. Br Med J (Clin Res Ed). 1987;294:1057-1059.
26. Ribstein J, Halimi JM, du Cailar G, Mimran A. Renal characteristics and effect of angiotensin suppression in oral contraceptive users. Hypertension. 1999;33:90-95.
27. Goldhaber SZ, Hennekens CH, Spark RF, et al. Sustrato de renina en plasma, actividad de renina y niveles de aldosterona en una muestra de usuarias de anticonceptivos orales de una encuesta comunitaria. Am Heart J. 1984;107:119-122.
28. Chasan-Taber L, Willett WC, Manson JE, et al. Estudio prospectivo de los anticonceptivos orales y la hipertensión entre las mujeres de los Estados Unidos. Circulation. 1996;94:483-489.
29. Baillargeon JP, McClish DK, Essah PA, Nestler JE. Association between the current use of low-dose oral contraceptives and cardiovascular arterial disease: a meta-analysis. J Clin Endocrinol Metab. 2005;90:3863-3870.
30. Rossouw JE, Anderson GL, Prentice RL, et al. Riesgos y beneficios del estrógeno más progestina en mujeres posmenopáusicas sanas: resultados principales del ensayo controlado aleatorio de la Iniciativa de Salud de la Mujer. JAMA. 2002;288:321-333.
31. Efectos de los regímenes de estrógeno o estrógeno/progestina sobre los factores de riesgo de enfermedades cardíacas en mujeres posmenopáusicas. The Postmenopausal Estrogen/Progestin Interventions (PEPI) Trial. JAMA. 1995;273:199-208.
32. Butkevich A, Abraham C, Phillips RA. Hormone replacement therapy and 24-hour blood pressure profile in postmenopausal women. Am J Hypertens. 2000;13:1039-1041.
33. Cagnacci A, Rovati L, Zanni A, et al. Las dosis fisiológicas de estradiol disminuyen la presión arterial nocturna en mujeres posmenopáusicas normotensas. Am J Physiol.1999;276:H1355-H1360.
34. Scuteri A, Bos AJ, Brant LJ, et al. Terapia de sustitución hormonal y cambios longitudinales en la presión arterial en mujeres posmenopáusicas. Ann Intern Med. 2001;135:229-238.
35. Bath PM, Gray LJ. Asociación entre la terapia hormonal sustitutiva y el accidente cerebrovascular posterior: un meta-análisis. BMJ. 2005;330:342.
36. Chen KJ. El efecto y el síndrome de abuso del ginseng. J Trad Chin Med. 1981;1:69-72.
37. Pittler MH, Schmidt K, Ernst E. Adverse events of herbal food supplements for body weight reduction: systematic review. Obes Rev. 2005;6:93-111.
38. Thase ME. Efectos de la venlafaxina en la presión arterial: un meta-análisis de los datos originales de 3744 pacientes deprimidos. J Clin Psychiatry. 1998;59:502-508.
39. Prospecto de Effexor XR (venlafaxina HCl). Philadelphia, PA: Wyeth Pharmaceuticals; febrero de 2008.
40. Venlafaxina: una nueva dimensión en la farmacoterapia antidepresiva. J Clin Psychiatr. 1993;54:119-126.
41. Lean ME. Sibutramina: una revisión de la eficacia clínica. Int J Obes Relat Metab Disord. 1997;21(suppl 1):S30-S36.
42. Weintraub M, Rubio A, Golik A, et al. Sibutramine in weight control: a dose-ranging, efficacy study. Clin Pharmacol Ther. 1991;50:330-337.
43. King DJ, Devaney N. Clinical pharmacology of sibutramine hydrochloride, a new antidepressant, in healthy volunteers. Br J Clin Pharmacol. 1988;26:607-611.
44. Perrio MJ, Wilton LV, Shakir SA. The safety profiles of orlistat and sibutramine: results of prescription-event monitoring studies in England. Obesity. 2007;15:2712-2722.
45. Vercauteren SB, Bosmans JL, Elseviers MM, et al. A meta-analysis and morphological review of cyclosporine-induced nephrotoxicity in auto-immune diseases. Kidney Int. 1998;54:536-545.
46. Kutkuhn B, Hollenbeck M, Heering P, et al. Desarrollo de resistencia a la insulina y elevación de la presión arterial durante el tratamiento con ciclosporina A. Blood Press. 1997;6:13-17.
47. Charnick SB, Nedelman JR, Chang CT, et al. Descripción de los cambios en la presión arterial en pacientes que inician la terapia con ciclosporina A. Ther Drug Monit. 1997;19:17-24.
48. Cush JJ, Tugwell P, Weinblatt M, Yocum D. US consensus guidelines for use of cyclosporin A in rheumatoid arthritis. J Rheumatol. 1999;26:1176-1186.
49. Pham S, Kormos R, Hattler B, et al. A prospective trial of tacrolimus in clinical heart transplantation: intermediate-term results. J Thorac Cardiovasc Surg. 1996;111:764-772.
50. Fung JJ, Todo S, Jain A, et al. Conversión de ciclosporina a FK 506 en receptores de aloinjertos hepáticos con complicaciones relacionadas con la ciclosporina. Transplant Proc. 1990;22:6-12.
51. Jain A, Reyes J, Kashyap R, et al. Trasplante hepático bajo tacrolimus en bebés, niños, adultos y ancianos: resultados a largo plazo, supervivencia y acontecimientos adversos en 1000 pacientes consecutivos. Transplant Proc.1998;30:1403-1404.
Para comentar este artículo, contacte con [email protected].