Apprentissage de la chimie
Qu’est-ce que le radon
Le radon (prononciation : RAY-don) est un élément inodore et radioactif qui appartient à la famille des gaz rares et est représenté par le symbole chimique Rn . Il est incolore à température ambiante, mais devient phosphorescent lorsqu’il est refroidi en dessous de sa température de congélation et se transforme progressivement en rouge-orange lorsque la température est encore abaissée jusqu’au point d’ébullition de l’air liquide .

Symbole du radon
Isotopes
Il existe plus de 35 isotopes radioactifs du radon, allant de 195Rn à 229Rn, parmi lesquels le 222Rn est le plus stable avec une période de demi-vie de 3.823 jours et forme 218Po par désintégration α. Il possède quatre isotopes naturels, dont le 218Rn, le 219Rn, le 220Rn et le 222Rn .
Où trouve-t-on le radon
Le radon est toujours présent dans la nature car il est produit par la décomposition radioactive du radium 226 qui est présent dans les roches phosphatées, les minerais d’uranium, les roches métamorphiques et les roches communes comme le calcaire . Une petite quantité de radon est également présente dans l’atmosphère .

Kit de test de radon
Histoire
Origine de son nom : Il doit son nom à l’élément métallique radioactif qu’est le radium car le radon a été identifié pour la première fois lors de la désintégration radioactive du radium .
Qui l’a découvert : Le physicien allemand Friedrich Ernst Dorn est connu pour sa découverte .
Quand et comment a-t-il été découvert
En 1899, Robert B. Owens et Ernest Rutherford trouvent un gaz radioactif émanant du thorium . La même année, Marie et Pierre Curie détectent un gaz émanant du radium . En 1900, Ernst Dorn découvre un gaz en étudiant la chaîne de désintégration du radium dans la ville allemande de Halle .
Nous savons maintenant que le gaz radioactif observé par les Curie et Ernst Dorn était du Radon-222 tandis que le gaz détecté par Rutherford était du Radon-220 . En 1908, Robert Whytlaw-Gray et William Ramsay ont collecté suffisamment de radon et ont déterminé les propriétés du radon au University College de Londres .
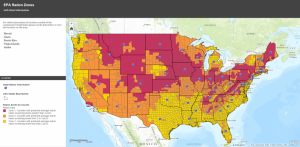
Carte des gaz radon de l’EPA
Radon Identification |
|||
| Numéro atomique | 86. | ||
| Numéro CAS | 10043-92-2 | ||
| Position dans le tableau périodique | Groupe | Période | Bloc |
| 18 | 6 | p | |
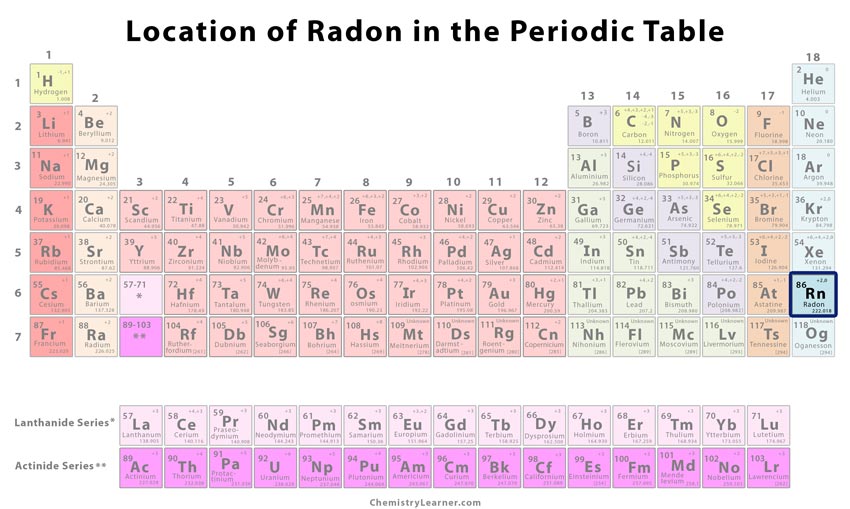
L’emplacement du radon sur le tableau périodique
Propriétés et caractéristiques du radon
Propriétés générales |
||||||||||||||||||
| Masse atomique relative | . masse atomique | |||||||||||||||||
| Masse atomique | amu | |||||||||||||||||
| Masse molaire | 210.9906010 ± 0.0000070 g/mol | |||||||||||||||||
Propriétés physiques |
||||||||||||||||||
| Couleur | Colorless | Point de fusion/congélation | -71 °C, -96 °F | |||||||||||||||
| Point d’ébullition | -61.7 °C, -79.1 °F | |||||||||||||||||
| Densité | 0.009074 g cm-3 | |||||||||||||||||
| État de la matière à température ambiante (solide/liquide/gaz) | Gaz | |||||||||||||||||
| Charge | Inconnu | |||||||||||||||||
| Conductivité thermique (chaleur) | 0.00361 W/(m K) | |||||||||||||||||
| Inflammabilité | Non inflammable | Chaleur spécifique | 94 J kg-1 K-1 | |||||||||||||||
| Modulus apparent | Inconnu. | |||||||||||||||||
| Module de cisaillement | Inconnu | |||||||||||||||||
| Module de Young | Inconnu | |||||||||||||||||
| Pression de vapeur | ||||||||||||||||||
| – Température (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||||
| – Pression (Pa) | – | – | – | – | – | – | – | – | – | – | – | |||||||
Chemical Propriétés |
||||||||||||||||||
| États d’oxydation | 2. | |||||||||||||||||
| Isotopes | Isotope | Masse | Abundance (%) | Half-vie | Mode de désintégration | |||||||||||||
| 211Rn | 210.991 | – | 14.6 h | β+, EC | ||||||||||||||
| – | α | |||||||||||||||||
| 220Rn | 220.011 | – | 55.6 s | α | ||||||||||||||
| 222Rn | 128.905 | – | 3.823 d | α | ||||||||||||||
Données atomiques du radon (élément 86)
| Électrons de valence | 8 | |||||||
| Nombres quantiques | ||||||||
| – n | ||||||||
| – ℓ | 1 | |||||||
| – mℓ | 1 | |||||||
| – ms | -1/2 | |||||||
| Configuration des électrons (configuration des gaz rares) | 4f145d106s26p6 | |||||||
| Structure atomique | ||||||||
| – Nombre d’électrons | ||||||||
| – Nombre de neutrons | 136 | |||||||
| – Nombre de protons | 86 | |||||||
| Radius de l’atome | ||||||||
| – Rayon atomique | 2.20 Å | – Rayon covalent | 1.46 Å | |||||
| Electronégativité (échelle Pauling-de Pauling) | Inconnue | |||||||
| Affinité électronique | Non stable | |||||||
| Énergie d’ionisation (kJ mol-.1) | 1ère | 2ème | 3ème | 4ème | 5ème | 6th | 7th | 8th |
| 1037.073 | – | – | – | – | – | – | ||
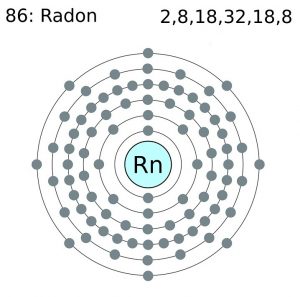
Radon Électron. Configuration (modèle de Bohr)
À quoi sert-il
- La décomposition radioactive du radon est utile pour obtenir du polonium .
- Le radon émis par une source de radium peut être utilisé dans la thérapie du cancer . Il était couramment utilisé dans les hôpitaux pour le traitement des tumeurs par l’implantation de minuscules tubes dans lesquels le gaz était scellé . Aujourd’hui, il a été remplacé par des options de traitement plus sûres .
- Les kits de dépistage du radon sont utilisés pour analyser les niveaux de radon à l’intérieur dans les endroits où de grandes concentrations de gaz radon peuvent s’accumuler à l’intérieur . Si le résultat du test montre que le niveau est de 4 pCi/L ou plus, des systèmes d’atténuation sont utilisés pour réduire les concentrations de radon .
- Les chercheurs utilisent la concentration de radon dans le sol pour cartographier les failles géologiques souterraines puisque les concentrations augmentent généralement au-dessus des failles . Les concentrations de radon dans les eaux souterraines sont également analysées pour la prévision des tremblements de terre .
Toxicité du radon et effets sur la santé
Les produits de désintégration du radon ont été considérés comme étant cancérigènes . Comme il peut être inhalé, les personnes exposées à des niveaux élevés de radon risquent de développer un cancer du poumon . Les chances d’être atteint d’un cancer du poumon sont beaucoup plus élevées chez les fumeurs qui sont exposés au radon. On pense qu’il a joué un rôle dans l’évolution et pourrait être responsable du rayonnement de fond de la Terre qui peut provoquer des modifications génétiques .
Faits intéressants
- C’est le gaz chimiquement inactif connu le plus lourd qui ne peut former des composés avec d’autres substances que dans des conditions extrêmes .
- Il est représenté graphiquement par une image du symbole de danger de radiation avec des images de fond de maisons indiquant que le gaz peut s’accumuler dans les maisons .
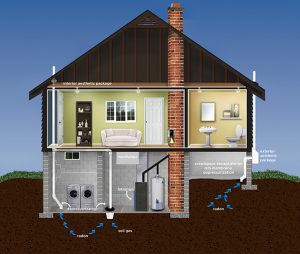
Système d’atténuation du radon
Coût du radon
Le prix du gaz radon est d’environ 4 $ par m .
- http://www.rsc.org/periodic-table/element/86/radon
- https://education.jlab.org/itselemental/ele086.html
- http://www.chemistryexplained.com/elements/P-T/Radon.html
- https://www.livescience.com/39546-radon.html
- https://education.jlab.org/itselemental/iso086.html
- https://www.webqc.org/molecular-weight-of-radon.html
- https://www.chemicool.com/elements/radon.html
- http://www.cabrillo.edu/~aromero/Common%20Files/Periodic%20Table%20(Common%20Ionic%20Charges).pdf
- http://periodictable.com/Elements/086/data.html
- https://www.atsdr.cdc.gov/toxprofiles/tp145-c4.pdf
- http://chemistry-reference.com/q_elements.asp?Symbol=Rn&language=en
- https://sosradon.org/mitigation
- http://www.ipgp.fr/~klinger/page_web/biblio/publication/Richon_RadMeas2010%20.pdf
- https://www.jstage.jst.go.jp/article/jpe1952/43/5/43_5_585/_pdf
- https://www.epa.gov/radon/health-risk-radon
- https://hobart.k12.in.us/ksms/PeriodicTable/radon.htm
.