Introduction à la chimie
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de :
- Prédire les structures de petites molécules en utilisant la théorie de la répulsion des paires d’électrons de la coquille de valence (VSEPR)
Jusqu’à présent, nous avons utilisé des structures de Lewis bidimensionnelles pour représenter les molécules. Cependant, la structure moléculaire est en réalité tridimensionnelle, et il est important de pouvoir décrire les liaisons moléculaires en termes de distances, d’angles et d’arrangements relatifs dans l’espace (figure 1). L’angle de liaison est l’angle entre deux liaisons qui comprennent un atome commun, généralement mesuré en degrés. La distance de liaison (ou longueur de liaison) est la distance entre les noyaux de deux atomes liés le long de la ligne droite reliant les noyaux. Les distances de liaison sont mesurées en Ångstroms (1 Å = 10-10 m) ou en picomètres (1 pm = 10-12 m, 100 pm = 1 Å).
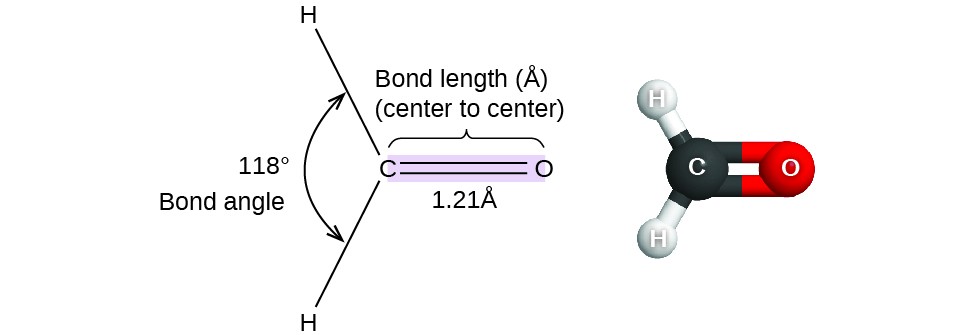
Figure 1. Les distances (longueurs) et les angles de liaison sont indiqués pour la molécule de formaldéhyde, H2CO.
Théorie VSEPR
La théorie de la répulsion des paires d’électrons de la coquille de valence (théorie VSEPR) nous permet de prédire la structure moléculaire, y compris les angles de liaison approximatifs autour d’un atome central, d’une molécule à partir d’un examen du nombre de liaisons et de paires d’électrons solitaires dans sa structure de Lewis. Le modèle VSEPR suppose que les paires d’électrons dans la coquille de valence d’un atome central adopteront un arrangement qui minimise les répulsions entre ces paires d’électrons en maximisant la distance qui les sépare. Les électrons de la couche de valence d’un atome central forment soit des paires d’électrons de liaison, situées principalement entre des atomes liés, soit des paires solitaires. La répulsion électrostatique de ces électrons est réduite lorsque les différentes régions de haute densité électronique prennent des positions aussi éloignées que possible les unes des autres.
La théorie VSEPR prédit la disposition des paires d’électrons autour de chaque atome central et, généralement, la disposition correcte des atomes dans une molécule. Il faut cependant comprendre que la théorie ne prend en compte que les répulsions des paires d’électrons. D’autres interactions, telles que les répulsions nucléaires-nucléaires et les attractions nucléaires-électroniques, sont également impliquées dans l’arrangement final que les atomes adoptent dans une structure moléculaire particulière.
Pour un exemple simple de la théorie VSEPR, prédisons la structure d’une molécule de CO2 gazeux. La structure de Lewis du CO2 (figure 2) ne montre que deux paires d’électrons autour de l’atome de carbone central. Avec deux liaisons et aucune paire d’électrons solitaires sur l’atome central, les liaisons sont aussi éloignées que possible les unes des autres, et la répulsion électrostatique entre ces régions de haute densité électronique est réduite au minimum lorsqu’elles se trouvent sur les côtés opposés de l’atome central. L’angle de liaison est de 180° (figure 2). La figure 3 illustre cette géométrie et d’autres géométries de paires d’électrons qui minimisent les répulsions entre les régions de haute densité électronique (liaisons et/ou paires solitaires). Deux régions de densité électronique autour d’un atome central dans une molécule forment une géométrie linéaire ; trois régions forment une géométrie plane trigonale ; quatre régions forment une géométrie tétraédrique ; cinq régions forment une géométrie bipyramidale trigonale ; et six régions forment une géométrie octaédrique.

Figure 2. Le dioxyde de carbone adopte une structure linéaire dans laquelle les deux liaisons sont aussi éloignées que possible, sur les côtés opposés de l’atome C

Figure 3. Les géométries de base des paires d’électrons prédites par la théorie VSEPR maximisent l’espace autour de toute région de densité électronique (liaisons ou paires solitaires).
Géométrie des paires d’électrons versus structure moléculaire
Il est important de noter que la géométrie des paires d’électrons autour d’un atome central n’est pas la même chose que sa structure moléculaire. Les géométries des paires d’électrons présentées dans la figure 3 décrivent toutes les régions où se trouvent les électrons, les liaisons comme les paires solitaires. La structure moléculaire décrit l’emplacement des atomes, pas des électrons.

Figure 4. La structure moléculaire de la molécule de méthane, CH4, est représentée avec un arrangement tétraédrique des atomes d’hydrogène.
Nous différencions ces deux situations en nommant la géométrie qui inclut toutes les paires d’électrons la géométrie à paires d’électrons. La structure qui inclut uniquement le placement des atomes dans la molécule est appelée structure moléculaire. Les géométries de paires d’électrons seront les mêmes que les structures moléculaires lorsqu’il n’y a pas de paires d’électrons solitaires autour de l’atome central, mais elles seront différentes lorsque des paires solitaires sont présentes sur l’atome central.
Les structures VSEPR comme celle de la figure 4 sont souvent dessinées à l’aide de la notation en coin et en tirets, dans laquelle les lignes pleines représentent les liaisons dans le plan de la page, les coins pleins représentent les liaisons qui montent hors du plan, et les lignes en tirets représentent les liaisons qui descendent dans le plan. Par exemple, la molécule de méthane, CH4, qui est le principal composant du gaz naturel, possède quatre paires d’électrons de liaison autour de l’atome de carbone central ; la géométrie des paires d’électrons est tétraédrique, tout comme la structure moléculaire (figure 4). D’autre part, la molécule d’ammoniac, NH3, possède également quatre paires d’électrons associées à l’atome d’azote, et présente donc une géométrie de paires d’électrons tétraédrique. L’une de ces régions, cependant, est une paire solitaire, qui n’est pas incluse dans la structure moléculaire, et cette paire solitaire influence la forme de la molécule (figure 5).

Figure 5. (a) La géométrie des paires d’électrons de la molécule d’ammoniac est tétraédrique avec une paire solitaire et trois liaisons simples. (b) La structure moléculaire pyramidale trigonale est déterminée à partir de la géométrie du couple d’électrons. (c) Les angles de liaison réels s’écartent légèrement des angles idéalisés, car le couple solitaire occupe une plus grande région de l’espace que les liaisons simples, ce qui fait que l’angle HNH est légèrement inférieur à 109,5°.
Comme on le voit sur la figure 5, de petites distorsions par rapport aux angles idéaux de la figure 6 peuvent résulter de différences de répulsion entre diverses régions de densité électronique. La théorie VSEPR prédit ces distorsions en établissant un ordre des répulsions et un ordre de la quantité d’espace occupé par les différents types de paires d’électrons. L’ordre des répulsions des paires d’électrons, de la plus grande à la plus petite, est le suivant :
paire solitaire-paire solitaire > paire solitaire-paire de liaison > paire de liaison-paire de liaison
Cet ordre des répulsions détermine la quantité d’espace occupée par différentes régions d’électrons. Une paire d’électrons solitaires occupe une région d’espace plus grande que les électrons d’une triple liaison ; à leur tour, les électrons d’une triple liaison occupent plus d’espace que ceux d’une double liaison, et ainsi de suite. L’ordre des tailles, de la plus grande à la plus petite, est le suivant :
paire unique > triple liaison > double liaison> simple liaison
Pensez au formaldéhyde, H2CO, qui est utilisé comme conservateur pour les spécimens biologiques et anatomiques (figure 1). Cette molécule possède des régions de haute densité électronique qui consistent en deux liaisons simples et une double liaison. La géométrie de base est un plan trigonal avec des angles de liaison de 120°, mais nous voyons que la double liaison provoque des angles légèrement plus grands (121°), et que l’angle entre les liaisons simples est légèrement plus petit (118°).
Dans la molécule d’ammoniac, les trois atomes d’hydrogène attachés à l’azote central ne sont pas disposés dans une structure moléculaire plane et trigonal, mais plutôt dans une pyramide trigonale tridimensionnelle (Figure 5) avec l’atome d’azote au sommet et les trois atomes d’hydrogène formant la base. Les angles de liaison idéaux dans une pyramide trigonale sont basés sur la géométrie des paires d’électrons tétraédriques. Là encore, il y a de légers écarts par rapport à l’idéal, car les paires solitaires occupent de plus grandes régions de l’espace que les électrons de liaison. Les angles de liaison H-N-H dans NH3 sont légèrement inférieurs à l’angle de 109,5° dans un tétraèdre régulier (figure 3) parce que la répulsion entre paire solitaire et paire de liaison est plus grande que la répulsion entre paire de liaison et paire de liaison (figure 5). La figure 6 illustre les structures moléculaires idéales, qui sont prédites sur la base des géométries des paires d’électrons pour diverses combinaisons de paires solitaires et de paires de liaison.

Figure 6. Les structures moléculaires sont identiques aux géométries des paires d’électrons lorsqu’il n’y a pas de paires solitaires présentes (première colonne). Pour un nombre particulier de paires d’électrons (ligne), les structures moléculaires pour une ou plusieurs paires solitaires sont déterminées sur la base des modifications de la géométrie de la paire d’électrons correspondante.
Selon la théorie VSEPR, les emplacements des atomes terminaux (Xs dans la figure 6) sont équivalents au sein des géométries de paires d’électrons linéaires, planes trigonales et tétraédriques (les trois premières lignes du tableau). Il importe peu de savoir quel X est remplacé par un doublet solitaire, car les molécules peuvent être tournées pour convertir les positions.
Prédire la géométrie des paires d’électrons et la structure moléculaire
La procédure suivante utilise la théorie VSEPR pour déterminer les géométries des paires d’électrons et les structures moléculaires :
- Écrire la structure de Lewis de la molécule ou de l’ion polyatomique.
- Compter le nombre de régions de densité électronique (paires solitaires et liaisons) autour de l’atome central. Une liaison simple, double ou triple compte comme une région de densité électronique.
- Identifiez la géométrie des paires d’électrons en fonction du nombre de régions de densité électronique : linéaire, plan trigonal ou tétraédrique. (Figure 6, première colonne).
- Utiliser le nombre de paires solitaires pour déterminer la structure moléculaire (Figure 6). Si plus d’un arrangement de paires solitaires et de liaisons chimiques est possible, choisissez celui qui minimisera les répulsions, en vous rappelant que les paires solitaires occupent plus d’espace que les liaisons multiples, qui occupent plus d’espace que les liaisons simples.
Les exemples suivants illustrent l’utilisation de la théorie VSEPR pour prédire la structure moléculaire de molécules ou d’ions qui n’ont pas de paires solitaires d’électrons. Dans ce cas, la structure moléculaire est identique à la géométrie des paires d’électrons.
Exemple 1 : Prédire la géométrie des paires d’électrons et la structure moléculaire
Prédire la géométrie des paires d’électrons et la structure moléculaire du phosgène, COCl2, un agent de guerre chimique utilisé pendant la Première Guerre mondiale
Les plusieurs exemples suivants illustrent l’effet des paires d’électrons solitaires sur la structure moléculaire.
Exemple 2 : prédire la géométrie des paires d’électrons et la structure moléculaire : Paires solitaires sur l’atome central
Prédire la géométrie des paires d’électrons et la structure moléculaire d’une molécule d’eau.
Exemple 3 : Simulation moléculaire
L’utilisation du simulateur de forme moléculaire nous permet de contrôler si les angles de liaison et/ou les paires solitaires sont affichés en cochant ou décochant les cases sous » Options » à droite. Nous pouvons également utiliser les cases à cocher « Nom » en bas à gauche pour afficher ou masquer la géométrie des paires d’électrons (appelée « géométrie électronique » dans le simulateur) et/ou la structure moléculaire (appelée « forme moléculaire » dans le simulateur).
Construisez la molécule HCN dans le simulateur sur la base de la structure de Lewis suivante :
\text{H-C}\equiv \text{N}
Cliquez sur chaque type de liaison ou paire solitaire à droite pour ajouter ce groupe à l’atome central. Une fois que vous avez la molécule complète, faites-la pivoter pour examiner la structure moléculaire prédite. Quelle est cette structure moléculaire ?
Concepts clés et résumé
La théorie VSEPR prédit l’arrangement tridimensionnel des atomes dans une molécule. Elle stipule que les électrons de valence adopteront une géométrie de paire d’électrons qui minimise les répulsions entre les zones de haute densité électronique (liaisons et/ou paires solitaires). La structure moléculaire, qui fait uniquement référence au placement des atomes dans une molécule et non aux électrons, est équivalente à la géométrie des paires d’électrons uniquement lorsqu’il n’y a pas de paires d’électrons solitaires autour de l’atome central.
Exercices
- Expliquez la différence entre la géométrie des paires d’électrons et la structure moléculaire.
- Pourquoi l’angle H-N-H dans NH3 est-il plus petit que l’angle de la liaison H-C-H dans CH4 ? Pourquoi l’angle H-N-H dans {\text{NH}}_{4}^{+} est identique à l’angle de liaison H-C-H dans CH4 ?
- Identifiez la géométrie du couple d’électrons et la structure moléculaire de chacune des molécules suivantes :
- CF4
- PCl3
- SeF4
- Identifiez la géométrie du couple d’électrons et la structure moléculaire de chacune des molécules suivantes :
- ClNO (N est l’atome central)
- Cl2CO (C est l’atome central)
- Cl2SO (S est l’atome central…
- Cl2SeO (Se est l’atome central)
- F2SO (S est l’atome central)
- Une molécule de formule AB3, dans laquelle A et B représentent des atomes différents, pourrait avoir l’une des trois formes différentes. Esquissez et nommez les trois formes différentes que cette molécule pourrait avoir. Donnez un exemple de molécule ou d’ion qui a chaque forme.
- Utilisez le simulateur de forme de molécule PhET pour construire une molécule. En commençant par l’atome central, cliquez sur la double liaison pour ajouter une double liaison. Ajoutez ensuite une liaison simple et une paire solitaire. Faites pivoter la molécule pour observer la géométrie complète. Nommez la géométrie du groupe d’électrons et la structure moléculaire et prédisez l’angle de liaison. Cliquez ensuite sur les cases à cocher en bas et à droite du simulateur pour vérifier vos réponses.
- Utilisez le simulateur de forme de molécule PhET pour explorer de vraies molécules. Dans l’onglet Molécules réelles, sélectionnez H2O. Passez du mode » réel » au mode » modèle « . Expliquez la différence observée.
- Utilisez le simulateur de forme de molécule PhET pour explorer les molécules réelles. Dans l’onglet Molécules réelles, sélectionnez le mode » modèle » et S2O. Quel est l’angle de liaison du modèle ? Expliquez si l’angle de liaison « réel » doit être plus grand ou plus petit que l’angle idéal du modèle.
Une molécule de formule AB2, dans laquelle A et B représentent des atomes différents, pourrait avoir l’une des trois formes différentes. Esquissez et nommez les trois formes différentes que cette molécule pourrait avoir. Donnez un exemple de molécule ou d’ion pour chaque forme.
Glossaire
angle de liaison : angle entre deux liaisons covalentes quelconques qui partagent un atome commun
distance de liaison : (aussi, longueur de la liaison) distance entre les noyaux de deux atomes liés
géométrie des paires d’électrons : disposition autour d’un atome central de toutes les régions de densité électronique (liaisons, paires solitaires ou électrons non appariés)
linéaire : forme dans laquelle deux groupes extérieurs sont placés sur des côtés opposés d’un atome central
structure moléculaire : structure qui comprend uniquement le placement des atomes dans la molécule
tétraédrique : forme dans laquelle quatre groupes extérieurs sont placés autour d’un atome central de sorte qu’une forme tridimensionnelle est générée avec quatre coins et 109.5° entre chaque paire et l’atome central
planaire trigonal : forme dans laquelle trois groupes extérieurs sont placés dans un triangle plat autour d’un atome central avec des angles de 120° entre chaque paire et l’atome central
Théorie de la répulsion des paires d’électrons de la coquille de valence (VSEPR) : théorie utilisée pour prédire les angles de liaison dans une molécule en se basant sur le positionnement des régions de haute densité électronique aussi éloignées que possible pour minimiser la répulsion électrostatique
vecteur : quantité ayant une magnitude et une direction
.


