Chimica Introduttiva
Obiettivi di apprendimento
Alla fine di questa sezione, sarai in grado di:
- Prevedere le strutture di piccole molecole usando la teoria della repulsione di coppia degli elettroni del guscio di valenza (VSEPR)
Finora abbiamo usato strutture bidimensionali di Lewis per rappresentare le molecole. Tuttavia, la struttura molecolare è in realtà tridimensionale, ed è importante essere in grado di descrivere i legami molecolari in termini di distanze, angoli e disposizioni relative nello spazio (Figura 1). Un angolo di legame è l’angolo tra due legami che includono un atomo comune, di solito misurato in gradi. Una distanza di legame (o lunghezza di legame) è la distanza tra i nuclei di due atomi legati lungo la linea retta che unisce i nuclei. Le distanze di legame sono misurate in Ångstrom (1 Å = 10-10 m) o picometri (1 pm = 10-12 m, 100 pm = 1 Å).
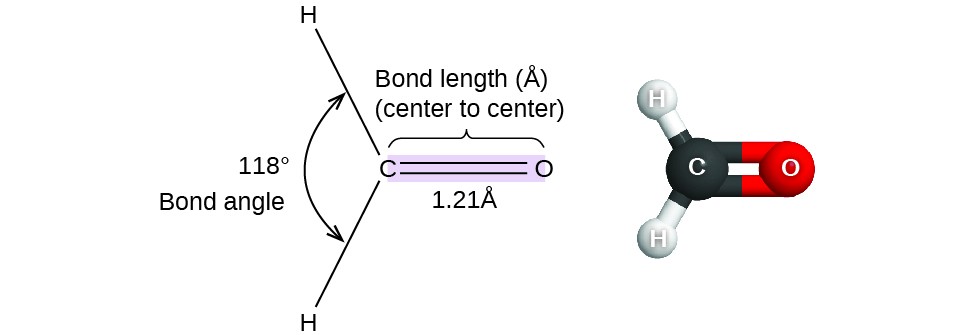
Figura 1. Le distanze di legame (lunghezze) e gli angoli sono mostrati per la molecola di formaldeide, H2CO.
Teoria VSEPR
La teoria della repulsione di coppia di elettroni nel guscio di valenza (teoria VSEPR) ci permette di predire la struttura molecolare, compresi gli angoli di legame approssimativi intorno ad un atomo centrale, di una molecola da un esame del numero di legami e coppie di elettroni solitari nella sua struttura Lewis. Il modello VSEPR presuppone che le coppie di elettroni nel guscio di valenza di un atomo centrale adottino una disposizione che minimizzi le repulsioni tra queste coppie di elettroni massimizzando la distanza tra loro. Gli elettroni nel guscio di valenza di un atomo centrale formano o coppie di elettroni di legame, situati principalmente tra atomi legati, o coppie solitarie. La repulsione elettrostatica di questi elettroni si riduce quando le varie regioni ad alta densità di elettroni assumono posizioni il più lontano possibile l’una dall’altra.
La teoria VSEPR predice la disposizione delle coppie di elettroni intorno ad ogni atomo centrale e, di solito, la corretta disposizione degli atomi in una molecola. Dobbiamo capire, tuttavia, che la teoria considera solo le repulsioni tra coppie di elettroni. Altre interazioni, come le repulsioni nucleari-nucleari e le attrazioni nucleari-elettroniche, sono anche coinvolte nella disposizione finale che gli atomi adottano in una particolare struttura molecolare.
Come semplice esempio della teoria VSEPR, prevediamo la struttura di una molecola gassosa di CO2. La struttura di Lewis della CO2 (figura 2) mostra solo due coppie di elettroni intorno all’atomo di carbonio centrale. Con due legami e nessuna coppia solitaria di elettroni sull’atomo centrale, i legami sono il più distanti possibile, e la repulsione elettrostatica tra queste regioni di alta densità di elettroni è ridotta al minimo quando sono sui lati opposti dell’atomo centrale. L’angolo di legame è di 180° (figura 2). La figura 3 illustra questa e altre geometrie di coppie di elettroni che minimizzano le repulsioni tra regioni ad alta densità di elettroni (legami e/o coppie solitarie). Due regioni di densità elettronica intorno ad un atomo centrale in una molecola formano una geometria lineare; tre regioni formano una geometria trigonale planare; quattro regioni formano una geometria tetraedrica; cinque regioni formano una geometria trigonale bipiramidale; e sei regioni formano una geometria ottaedrica.

Figura 2. L’anidride carbonica adotta una struttura lineare in cui i due legami sono il più distanti possibile, sui lati opposti dell’atomo di C

Figura 3 Le geometrie di base delle coppie di elettroni previste dalla teoria VSEPR massimizzano lo spazio intorno a qualsiasi regione di densità elettronica (legami o coppie solitarie).
Geometria delle coppie di elettroni rispetto alla struttura molecolare
È importante notare che la geometria delle coppie di elettroni intorno a un atomo centrale non è la stessa cosa della sua struttura molecolare. Le geometrie delle coppie di elettroni mostrate nella figura 3 descrivono tutte le regioni in cui si trovano gli elettroni, sia i legami che le coppie solitarie. La struttura molecolare descrive la posizione degli atomi, non degli elettroni.

Figura 4. La struttura molecolare della molecola di metano, CH4, è mostrata con una disposizione tetraedrica degli atomi di idrogeno.
Distinguiamo tra queste due situazioni chiamando la geometria che include tutte le coppie di elettroni la geometria a coppie di elettroni. La struttura che include solo la disposizione degli atomi nella molecola è chiamata struttura molecolare. Le geometrie di coppia di elettroni saranno le stesse delle strutture molecolari quando non ci sono coppie di elettroni solitari intorno all’atomo centrale, ma saranno diverse quando ci sono coppie solitarie presenti sull’atomo centrale.
Le strutture VSEPR come quella in figura 4 sono spesso disegnate usando la notazione di cuneo e trattino, in cui le linee solide rappresentano i legami nel piano della pagina, i cunei solidi rappresentano i legami che salgono dal piano, e le linee tratteggiate rappresentano i legami che scendono nel piano. Per esempio, la molecola del metano, CH4, che è il componente principale del gas naturale, ha quattro coppie di elettroni di legame intorno all’atomo di carbonio centrale; la geometria delle coppie di elettroni è tetraedrica, come la struttura molecolare (Figura 4). D’altra parte, anche la molecola di ammoniaca, NH3, ha quattro coppie di elettroni associate all’atomo di azoto, e quindi ha una geometria tetraedrica delle coppie di elettroni. Una di queste regioni, tuttavia, è una coppia solitaria, che non è inclusa nella struttura molecolare, e questa coppia solitaria influenza la forma della molecola (Figura 5).

Figura 5. (a) La geometria della coppia di elettroni per la molecola di ammoniaca è tetraedrica con una coppia solitaria e tre legami singoli. (b) La struttura molecolare trigonale piramidale è determinata dalla geometria della coppia di elettroni. (c) Gli angoli di legame reali deviano leggermente dagli angoli idealizzati, perché la coppia solitaria occupa una regione di spazio maggiore rispetto ai legami singoli, causando un angolo HNH leggermente più piccolo di 109,5°.
Come si è visto nella figura 5, piccole distorsioni dagli angoli ideali della figura 6 possono derivare da differenze di repulsione tra varie regioni di densità elettronica. La teoria VSEPR predice queste distorsioni stabilendo un ordine delle repulsioni e un ordine della quantità di spazio occupato da diversi tipi di coppie di elettroni. L’ordine delle repulsioni delle coppie di elettroni dalla più grande alla meno repulsione è:
coppia solitaria-coppia solitaria > coppia solitaria-coppia di legame > coppia di legame-coppia di legame
Questo ordine di repulsioni determina la quantità di spazio occupato da diverse regioni di elettroni. Una coppia solitaria di elettroni occupa una regione di spazio più grande degli elettroni in un triplo legame; a sua volta, gli elettroni in un triplo legame occupano più spazio di quelli in un doppio legame, e così via. L’ordine delle dimensioni dalla più grande alla più piccola è:
coppia singola > triplo legame > doppio legame>singolo legame
Considera la formaldeide, H2CO, che è usata come conservante per campioni biologici e anatomici (Figura 1). Questa molecola ha regioni ad alta densità di elettroni che consistono di due legami singoli e un doppio legame. La geometria di base è trigonale planare con angoli di legame di 120°, ma vediamo che il doppio legame causa angoli leggermente più grandi (121°), e l’angolo tra i legami singoli è leggermente più piccolo (118°).
Nella molecola dell’ammoniaca, i tre atomi di idrogeno attaccati all’azoto centrale non sono disposti in una struttura molecolare piatta, trigonale planare, ma piuttosto in una piramide trigonale tridimensionale (Figura 5) con l’atomo di azoto al vertice e i tre atomi di idrogeno che formano la base. Gli angoli di legame ideali in una piramide trigonale sono basati sulla geometria tetraedrica della coppia di elettroni. Di nuovo, ci sono leggere deviazioni dall’ideale perché le coppie solitarie occupano regioni di spazio più grandi degli elettroni di legame. Gli angoli di legame H-N-H in NH3 sono leggermente più piccoli dell’angolo di 109,5° in un tetraedro regolare (Figura 3) perché la repulsione coppia solitaria-coppia di legame è maggiore della repulsione coppia di legame-coppia di legame (Figura 5). La figura 6 illustra le strutture molecolari ideali, che sono previste sulla base delle geometrie delle coppie di elettroni per varie combinazioni di coppie solitarie e coppie di legame.

Figura 6. Le strutture molecolari sono identiche alle geometrie delle coppie di elettroni quando non sono presenti coppie solitarie (prima colonna). Per un particolare numero di coppie di elettroni (riga), le strutture molecolari per una o più coppie solitarie sono determinate in base alle modifiche della corrispondente geometria di coppia di elettroni.
Secondo la teoria VSEPR, le posizioni degli atomi terminali (Xs nella figura 6) sono equivalenti all’interno delle geometrie di coppia di elettroni lineare, trigonale planare e tetraedrica (le prime tre righe della tabella). Non importa quale X viene sostituita con una coppia solitaria, perché le molecole possono essere ruotate per convertire le posizioni.
Predicendo la geometria delle coppie di elettroni e la struttura molecolare
La seguente procedura usa la teoria VSEPR per determinare le geometrie delle coppie di elettroni e le strutture molecolari:
- Scrivi la struttura di Lewis della molecola o dello ione poliatomico.
- Conta il numero di regioni di densità elettronica (coppie solitarie e legami) attorno all’atomo centrale. Un legame singolo, doppio o triplo conta come una regione di densità elettronica.
- Identifica la geometria delle coppie di elettroni in base al numero di regioni di densità elettronica: lineare, trigonale planare o tetraedrica. (Figura 6, prima colonna).
- Utilizza il numero di coppie solitarie per determinare la struttura molecolare (Figura 6). Se è possibile più di una disposizione delle coppie solitarie e dei legami chimici, scegli quella che minimizzerà le repulsioni, ricordando che le coppie solitarie occupano più spazio dei legami multipli, che occupano più spazio dei legami singoli.
I seguenti esempi illustrano l’uso della teoria VSEPR per prevedere la struttura molecolare di molecole o ioni che non hanno coppie solitarie di elettroni. In questo caso, la struttura molecolare è identica alla geometria della coppia di elettroni.
Esempio 1: Prevedere la geometria della coppia di elettroni e la struttura molecolare
Prevedere la geometria della coppia di elettroni e la struttura molecolare del fosgene, COCl2, un agente di guerra chimica usato durante la prima guerra mondiale
I prossimi esempi illustrano l’effetto delle coppie solitarie di elettroni sulla struttura molecolare.
Esempio 2: Predire la geometria delle coppie di elettroni e la struttura molecolare: Coppie solitarie sull’atomo centrale
Prevedere la geometria delle coppie di elettroni e la struttura molecolare di una molecola d’acqua.
Esempio 3: Simulazione molecolare
L’uso del simulatore di forma molecolare ci permette di controllare se gli angoli di legame e/o le coppie solitarie sono visualizzati selezionando o deselezionando le caselle sotto “Opzioni” sulla destra. Possiamo anche usare le caselle di controllo “Name” in basso a sinistra per visualizzare o nascondere la geometria della coppia di elettroni (chiamata “electron geometry” nel simulatore) e/o la struttura molecolare (chiamata “molecular shape” nel simulatore).
Costruisci la molecola HCN nel simulatore basandoti sulla seguente struttura di Lewis:
\testo{H-C}equiv \testo{N}
Clicca su ogni tipo di legame o coppia solitaria sulla destra per aggiungere quel gruppo all’atomo centrale. Una volta che hai la molecola completa, ruotala per esaminare la struttura molecolare prevista. Che struttura molecolare è questa?
Esercizi
- Spiega la differenza tra geometria a coppie di elettroni e struttura molecolare.
- Perché l’angolo H-N-H in NH3 è minore dell’angolo di legame H-C-H in CH4? Perché l’angolo H-N-H in {\text{NH}}_{4}^{+} è identico all’angolo di legame H-C-H in CH4?
- Identifica la geometria della coppia di elettroni e la struttura molecolare di ciascuna delle seguenti molecole:
- CF4
- PCl3
- SeF4
- Identifica la geometria della coppia di elettroni e la struttura molecolare di ciascuna delle seguenti molecole:
- ClNO (N è l’atomo centrale)
- Cl2CO (C è l’atomo centrale)
- Cl2SO (S è l’atomo centrale centrale)
- Cl2SeO (Se è l’atomo centrale)
- F2SO (S è l’atomo centrale)
- Una molecola con la formula AB2, in cui A e B rappresentano atomi diversi, potrebbe avere una delle tre diverse forme. Disegna e nomina le tre diverse forme che questa molecola potrebbe avere. Dai un esempio di una molecola o di uno ione per ogni forma.
- Una molecola con la formula AB3, in cui A e B rappresentano atomi diversi, potrebbe avere una delle tre forme diverse. Disegna e nomina le tre diverse forme che questa molecola potrebbe avere. Fai un esempio di una molecola o di uno ione che ha ciascuna forma.
- Usa il simulatore PhET Molecule Shape per costruire una molecola. Iniziando dall’atomo centrale, clicca sul doppio legame per aggiungere un doppio legame. Poi aggiungi un legame singolo e una coppia solitaria. Ruota la molecola per osservare la geometria completa. Dai un nome alla geometria del gruppo di elettroni e alla struttura molecolare e predici l’angolo di legame. Poi clicca sulle caselle di controllo in basso e a destra del simulatore per controllare le tue risposte.
- Usa il simulatore PhET Molecule Shape per esplorare molecole reali. Nella scheda Molecole reali, seleziona H2O. Passa dalla modalità “reale” a quella “modello”. Spiegare la differenza osservata.
- Utilizzare il simulatore PhET Molecule Shape per esplorare le molecole reali. Nella scheda Molecole reali, seleziona la modalità “modello” e S2O. Qual è l’angolo di legame del modello? Spiega se l’angolo di legame “reale” dovrebbe essere più grande o più piccolo dell’angolo ideale del modello.
Glossario
angolo di legame: angolo tra due legami covalenti che condividono un atomo comune
distanza di legame: (anche, lunghezza di legame) distanza tra i nuclei di due atomi legati
geometria di coppia di elettroni: disposizione attorno ad un atomo centrale di tutte le regioni di densità elettronica (legami, coppie solitarie o elettroni spaiati)
lineare: forma in cui due gruppi esterni sono posti ai lati opposti di un atomo centrale
struttura molecolare: struttura che comprende solo la disposizione degli atomi nella molecola
tetraedrico: forma in cui quattro gruppi esterni sono disposti intorno ad un atomo centrale in modo da generare una forma tridimensionale con quattro angoli e 109.5° tra ogni coppia e l’atomo centrale
trigonale planare: forma in cui tre gruppi esterni sono disposti in un triangolo piatto intorno a un atomo centrale con angoli di 120° tra ogni coppia e l’atomo centrale
teoria della repulsione di coppia di elettroni nel guscio di valenza (VSEPR): teoria usata per predire gli angoli di legame in una molecola basata sul posizionamento di regioni ad alta densità di elettroni il più lontano possibile per minimizzare la repulsione elettrostatica
vettore: quantità con grandezza e direzione


