Le sel net pas faire fondre la glace – voicis comment il rend réellement les rues d’hiver sûres
Brrr … il fait froid dehors ! Les enfants se pressent devant la télévision dans l’espoir d’entendre qu’il y aura un jour de neige ; les allées de pain et de lait des épiceries sont vides en raison de l’imminence d’une tempête de neige ; et les camions de services publics sont dehors à pulvériser du sel ou de l’eau salée sur les routes.
Nous savons tous pourquoi les deux premiers se produisent – les enfants sont excités à l’idée d’un jour de congé scolaire rempli de chocolat chaud et de bonhommes de neige. Les adultes font des réserves de produits de première nécessité. Mais que se passe-t-il avec ces camions ?
Ils s’efforcent de protéger les conducteurs des conditions glissantes en pulvérisant du sel gemme ou une solution d’eau salée pour empêcher la formation de glace. Ce sel est très similaire au sel que vous avez sur votre table de dîner – c’est le même chlorure de sodium, NaCl. Il existe des mélanges exclusifs qui contiennent d’autres sels – comme le chlorure de potassium (KCl) et le chlorure de magnésium (MgCl) – mais ils ne sont pas aussi couramment utilisés.
Le sel de voirie n’est pas aussi pur que celui que vous utilisez sur vos aliments ; il a une couleur gris brunâtre, principalement due à la contamination minérale. Soumettre l’environnement à ce sel via le ruissellement peut avoir des conséquences inattendues, notamment des effets négatifs sur les plantes, les animaux aquatiques et les zones humides.
Mais c’est un moyen bon marché et efficace de protéger les routes de la glace en raison d’un principe scientifique simple : la dépression du point de congélation des solutions. Le point de congélation de l’eau pure, la température à laquelle elle devient de la glace, est de 32 degrés Fahrenheit. Donc, s’il y a de la neige, du grésil ou de la pluie verglaçante et que le sol est à 32 F ou plus froid, de la glace solide se formera sur les rues et les trottoirs.
Si l’eau est mélangée à du sel, cependant, la température de congélation de la solution est inférieure à 32 F. Le sel entrave la capacité des molécules d’eau à former des cristaux de glace solides. Le degré d’abaissement du point de congélation dépend du degré de salinité de la solution.
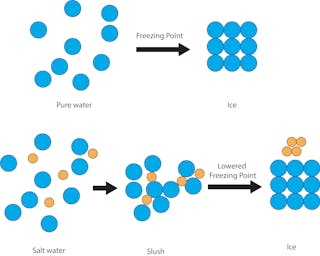
Il est important de noter que le sel doit être en solution avec l’eau liquide pour que ce principe soit respecté. C’est pourquoi de nombreuses villes pulvérisent une solution de sel avant toute formation de glace.
Le sel déversé sur la glace compte sur le soleil ou la friction des pneus des voitures qui roulent dessus pour faire fondre initialement la glace en une neige fondue qui peut se mélanger au sel et qui ne regèlera pas ensuite. Le prétraitement au sel solide repose sur la surface de la route, plus chaude, pour faire fondre la neige ou la pluie verglaçante afin qu’elle puisse se mélanger au sel. C’est aussi la raison pour laquelle le prétraitement des ponts – qui sont plus froids que les autres routes – ne fonctionne généralement pas, et pourquoi vous voyez des panneaux » le pont gèle avant la route « .
Ces solutions salines diminuent la température de congélation de l’eau à environ 15 F. Donc, malheureusement pour les personnes confrontées à des températures vraiment glaciales, le traitement au sel ne permettra pas de se débarrasser de la glace sur leurs routes.
Une stratégie alternative utilisée à ces températures plus basses consiste à mettre du sable sur la glace. Le sable ne change pas la température de fonte, il fournit simplement une surface rugueuse pour vos pneus afin d’éviter de glisser.

La science de la dépression du point de congélation peut être appliquée à n’importe quelle solution, et de nombreux groupes de recherche se sont concentrés sur le développement d’alternatives ayant moins de conséquences négatives sur l’environnement. Elles comprennent des additifs tels que la mélasse et le jus de betterave. Ainsi, vous pourrez peut-être vous réjouir de nettoyer non seulement le sel blanc sur le bas de vos jeans après une promenade hivernale, mais aussi le sel rose.