Zout doethet ijs niet smelten – hiers hoe het de straten in de winter juist veiliger maakt
Brrr … het is koud buiten! Kinderen kijken massaal naar de televisie in de hoop te horen dat er een sneeuwdag komt; de brood- en melkrekken in de supermarkt zijn leeg omdat er een sneeuwstorm op komst is; en de vrachtwagens van de nutsbedrijven strooien zout of zout water op de wegen.
We weten allemaal waarom de eerste twee dingen gebeuren – kinderen zijn enthousiast over een vrije dag van school gevuld met warme chocolademelk en sneeuwpoppen. Volwassenen slaan hun voorraden in. Maar hoe zit het met die vrachtwagens?
Ze beschermen automobilisten tegen gladheid door steenzout of een oplossing van zout water te strooien om ijsvorming te voorkomen. Dit zout lijkt sterk op het zout op uw tafel – het is hetzelfde natriumchloride, NaCl. Er zijn enkele eigen mengsels die andere zouten bevatten – zoals kaliumchloride (KCl) en magnesiumchloride (MgCl) – maar die worden niet zo vaak gebruikt.
Wegzout is niet zo zuiver als wat u voor uw voedsel gebruikt; het heeft een bruingrijze kleur, meestal door minerale verontreiniging. Het blootstellen van het milieu aan dit zout via afspoeling kan een aantal onbedoelde gevolgen hebben, waaronder negatieve effecten op planten, waterdieren en wetlands.
Maar het is een goedkope en effectieve manier om wegen tegen ijs te beschermen vanwege een eenvoudig wetenschappelijk principe: vriespuntdepressie van oplossingen. Het vriespunt van zuiver water, de temperatuur waarbij het ijs wordt, is 32 graden Fahrenheit. Dus als er sneeuw, ijzel of aanvriezende regen valt en de grond is 32 graden F of kouder, dan vormt zich vast ijs op straten en trottoirs.
Als het water echter wordt gemengd met zout, dan is de vriestemperatuur van de oplossing lager dan 32 graden F. Het zout belemmert het vermogen van de watermoleculen om vaste ijskristallen te vormen. De mate van vriespuntdaling hangt af van hoe zout de oplossing is.
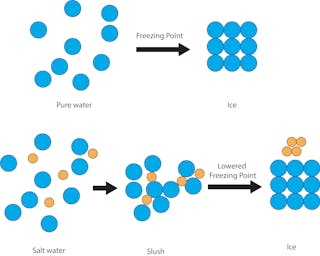
Het is belangrijk op te merken dat het zout in een oplossing met vloeibaar water moet zitten om aan dit principe te kunnen voldoen.
Zout dat bovenop het ijs wordt gestrooid, is afhankelijk van de zon of de wrijving van autobanden die eroverheen rijden om het ijs te laten smelten tot een smeltwater dat zich met het zout kan vermengen en vervolgens niet opnieuw bevriest. Voorbehandeling met vast zout is afhankelijk van het warmere wegdek om sneeuw of ijzel te laten smelten zodat het zich goed met het zout kan vermengen. Dit is ook de reden waarom het voorbehandelen van bruggen – die kouder zijn dan andere wegen – meestal niet werkt, en waarom je borden ziet met “brug bevriest eerder dan weg”.
Deze zoutoplossingen verlagen de bevriezingstemperatuur van water tot ongeveer 15 F. Dus, helaas voor mensen die te maken hebben met echt koude temperaturen, zal behandelen met zout het ijs op hun wegen niet wegnemen.
Een alternatieve strategie die bij deze lagere temperaturen wordt gebruikt, is het strooien van zand op het ijs. Zand verandert de smelttemperatuur niet, maar zorgt alleen voor een ruw oppervlak voor de banden om uitglijden te voorkomen.

De wetenschap van vriespuntverlaging kan op elke oplossing worden toegepast, en veel onderzoeksgroepen hebben zich gericht op het ontwikkelen van alternatieven met minder negatieve gevolgen voor het milieu. Daartoe behoren additieven zoals melasse en bietensap. Misschien kunt u zich er dus op verheugen om na een winterwandeling niet alleen wit zout van de onderkant van uw spijkerbroek te poetsen, maar ook roze zout.