ECG Pointers: Pacemaker… e quando funzionano male
Autore: David Bussé, MD, MBA (Medico residente EM, UTSW / Parkland Memorial Hospital) // A cura di: Jamie Santistevan, MD (@jamie_rae_EMdoc – Medico EM, Presbyterian Hospital, Albuquerque, NM); Manpreet Singh, MD (@MPrizzleER – Assistente professore di medicina d’urgenza / Dipartimento di medicina d’urgenza – Harbor-UCLA Medical Center); e Brit Long, MD (@long_brit – EM Attending Physician, San Antonio, TX)
Benvenuti a questa edizione di ECG Pointers, una serie emDOCs progettato per darvi consigli ad alto rendimento su ECG per mantenere le vostre abilità di interpretazione tagliente. Per un’immersione più profonda sugli ECG, includeremo link ad altri grandi ECG FOAMed!
Il caso:
Un uomo di 76 anni con HTN, DM, CAD e stato di blocco cardiaco di 3° grado dopo il posizionamento del pacemaker 8 anni fa presenta al vostro ED con dispnea da sforzo e un episodio di sincope in precedenza oggi. I suoi segni vitali al triage sono T 37.2C, HR 38, BP 118/78, RR 18 e O2 Sat 96% con aria ambiente. Il paziente che vedete davanti a voi è di bell’aspetto e risponde alle domande in modo appropriato. È in grado di dichiarare che, a causa di problemi di assicurazione, non è stato in grado di fissare un appuntamento con un cardiologo negli ultimi 3 anni.
Il suo ECG iniziale rivela quanto segue:
Funzione del pacemaker

I pacemaker sono formati da più componenti:
- Il generatore di impulsi contiene la batteria. Viene impiantato nei tessuti molli o nei muscoli della parete anteriore del torace. La maggior parte dei pacemaker ha una durata della batteria di 5-10 anni. La durata della batteria dipende dalla frequenza con cui il pacemaker rileva e stimola, rendendo difficile una previsione accurata della sua durata. La sostituzione tempestiva richiede un adeguato follow-up.
- I cavi del pacemaker collegano il generatore di impulsi al miocardio. Gli elettrocateteri sono posizionati nel ventricolo destro per i pacemaker a camera singola. I pacemaker bicamerali hanno elettrocateteri nell’atrio destro e nel ventricolo destro. Infine, i pacemaker biventricolari (risincronizzazione) collocano gli elettrocateteri nell’atrio destro, nel ventricolo destro e nel seno coronarico (che stimola il ventricolo sinistro). La frattura degli elettrocateteri o la rottura del rivestimento isolato possono portare a una funzionalità di stimolazione/sensazione impropria.
- La stimolazione avviene quando una differenza di potenziale (tensione) viene applicata tra due elettrodi. La soglia di stimolazione è la quantità minima di energia necessaria per depolarizzare il miocardio, descritta da ampiezza (volt) e durata. Queste caratteristiche sono programmabili e influenzano la longevità della batteria.
I pacemaker sono completamente descritti da un codice a 5 posizioni, con le prime 3 posizioni che definiscono la funzione del dispositivo. Queste possono essere ricordate dal mnemonico PaSeR1 – funzione di stimolazione, posizione di rilevamento e risposta al rilevamento.
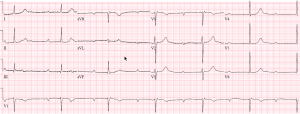
L’impostazione più comune per i dispositivi bicamerali è DDD, in cui il pacemaker stimola e rileva sia l’atrio che il ventricolo. Se viene rilevato un battito nativo, il pacemaker viene inibito. Se non viene rilevato alcun battito nativo dopo un intervallo di tempo stabilito, il pacemaker emette un battito attivato.
Questo è un paziente con un pacemaker DDD normalmente funzionante:
Malfunzionamento del pacemaker
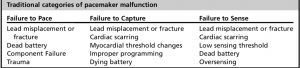
Il fallimento del pacemaker è stato tradizionalmente diviso in 3 categorie:
- Il mancato ritmo suggerisce che il generatore di impulsi non sta fornendo una tensione sufficiente per depolarizzare il miocardio. L’ECG non mostra né picchi del pacer né complessi QRS indotti dal pacer, ma piuttosto il ritmo nativo del paziente.
- La mancata cattura si verifica quando viene dato un impulso del pacemaker, ma l’impulso non è in grado di depolarizzare il tessuto miocardico non refrattario. I picchi del pacemaker si vedono su un ECG, ma non c’è risposta cardiaca. Ancora una volta, il ritmo nativo del paziente è visto sull’ECG. La fibrosi dalla risposta infiammatoria locale settimane dopo l’impianto (incidenza ridotta a causa degli elettrocateteri a rilascio di steroidi) oltre alla frattura/dislocazione dell’elettrocatetere, la sindrome di Twiddler e la perforazione cardiaca possono essere i colpevoli.
- Il mancato rilevamento comprende sia l’oversensing che il undersensing. Con oversensing, il pacemaker interpreta erroneamente altri segnali (onde T a picco, interferenze elettromagnetiche, attività muscolare scheletrica) per essere complessi QRS, inibendo la risposta e non riuscendo a iniziare il pacing. Con undersensing, il pacemaker non è in grado di interpretare correttamente l’attività cardiaca nativa a causa dei cambiamenti dei segnali intracardiaci (ischemia miocardica, nuovi blocchi di fascio, PVC). La sensibilità può essere riprogrammata per migliorare questi problemi.
- Questa categorizzazione storica ha poco valore nell’impostazione acuta, in quanto le cause tendono a sovrapporsi notevolmente, e tutti sono gestiti in modo simile.
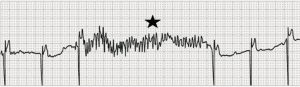
Myopotential oversensing e inibizione del pacing: L’attività del muscolo scheletrico viene confusa con l’attività cardiaca (stella) con conseguente inibizione del pacing in un paziente con pacemaker programmato in modalità VVI.
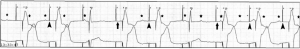
Undersensing e perdita di cattura: Le onde P sono contrassegnate da asterischi. Undersensing (punta di freccia) si nota quando un’onda P è seguita da un picco di stimolazione. La perdita di cattura (freccia) si nota quando un picco di stimolazione opportunamente temporizzato non riesce a generare un’onda P.
Approccio al malfunzionamento del pacemaker
- Sospettare il malfunzionamento del pacemaker in caso di lamentele di testa leggera, affaticamento, palpitazioni, singhiozzo, confusione, dispnea, contrazioni muscolari e sincope.
- L’anamnesi deve accertare se il paziente ha qualche problema sottostante che porta al malfunzionamento del pacemaker. Questi includono ACS, traumi, cambiamenti di farmaci o una recente riprogrammazione del dispositivo.
- Ai pazienti vengono date delle schede con il tipo di dispositivo, il modello, il produttore e la data di impianto del dispositivo.
- Chiedere ai pazienti di fornire la loro scheda del pacemaker.
- L’esame fisico deve iniziare con una revisione dei segni vitali, dello stato mentale e dello stato cardiopolmonare. Notare i segni di infezione, migrazione o trauma nel sito dell’impianto. Cercare anche JVD, onde A a cannone, contrazioni del muscolo pettorale e nuovi murmure/rubate cardiaci.
- Ottenere un ECG per determinare se è presente una bradicardia instabile. Confrontarlo con gli ECG precedenti, osservando in particolare i cambiamenti di asse.
- L’ECG di un paziente con un solo ventricolo stimolato mostrerà picchi di pacer ventricolare e un LBBB con deviazione dell’asse sinistro a causa del posizionamento dell’elettrodo nel RV.
- I pacer biventricolari che catturano la parete libera del LV dimostrano un’onda R dominante in V1 e un complesso QS nella derivazione I, indicando un fronte d’onda che si propaga dal LV6.
- I segmenti ST e le onde T devono essere discordanti con il QRS.
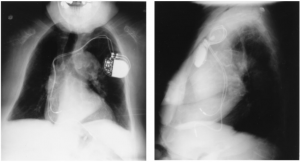
- Ottenere radiografie del torace in PA e laterali per verificare l’eventuale dislocazione dell’elettrocatetere, frattura o pneumotorace. Se un paziente non è in grado di produrre la scheda del pacer, una radiografia del torace iperpenetrata può essere utilizzata per determinare il produttore del dispositivo identificando il simbolo della società.
- Ottenere misurazioni sieriche degli elettroliti e di eventuali farmaci cardiotossici oltre ai biomarcatori cardiaci nel contesto appropriato. Derangements metabolici tra cui ipotiroidismo, acidosi e ipopotassiemia possono alterare la soglia potenziale richiesta per il pacing.
- La gestione è dettata dai sintomi del paziente e dallo stato emodinamico. Le piastre di stimolazione transcutanea devono essere posizionate sul paziente in una configurazione anteriore-posteriore ogni volta che si sospetta un malfunzionamento. Applicare i protocolli standard ACLS se un paziente è bradicardico con sintomi di ipoperfusione.
- Quando è emodinamicamente stabile, interrogare il pacemaker. L’interrogazione fornisce informazioni sulla durata della batteria, sulle soglie di rilevamento e di stimolazione (sotto/sovrasenso), sull’integrità del sistema di elettrocateteri (frattura degli stessi) e sulle registrazioni del ritmo cardiaco. L’interrogazione può indicare il corretto funzionamento o la presenza di aritmie che aiutano a stratificare il rischio del paziente.
- L’interrogazione comporta la comunicazione a radiofrequenza con il pacemaker posizionando una bacchetta sul dispositivo. La bacchetta è collegata a un programmatore che esegue l’interrogazione, ed è specifico per ogni azienda di dispositivi.
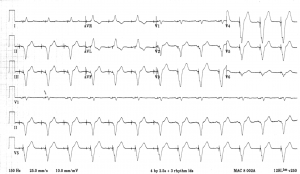
Questo è un esempio di un paziente con bradicardia nonostante il posizionamento del pacemaker:
Disritmie/Sindromi indotte dal pacemaker:
- Applicare i criteri di Sgarbossa ai pazienti con pacemaker quando si sospetta un ACS.
- La tachicardia mediata dal pacemaker (PMT) è una tachicardia a ciclo rientrante unica nei pacemaker bicamerali. Un PVC viene consegnato agli atri in modo retrogrado. Questa depolarizzazione ventricolare stimola il rilevamento atriale, innescando un’altra depolarizzazione ventricolare; si crea un loop che imposta la disritmia al limite superiore di frequenza del pacemaker. Un magnete clinico o qualsiasi terapia che aumenta il periodo refrattario al nodo AV (adenosina, CCBs, BBs) terminerà l’aritmia.
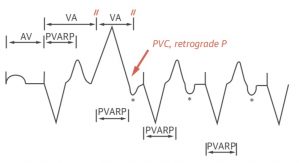
Tachicardia mediata da pacemaker: Il primo battito illustra il pacing sequenziale AV, seguito da un battito PVC. Il PVC inizia un nuovo intervallo VA. Qualsiasi evento di disaccoppiamento AV (più frequentemente PVC) può condurre retrogradamente all’atrio. Un evento atriale viene rilevato se cade al di fuori del periodo refrattario atriale post-ventricolare (PVARP). L’intervallo VA scade e viene attivato un nuovo intervallo AV. La stimolazione ventricolare si verifica alla fine dell’intervallo AV, creando una serie circuitale di eventi denominata tachicardia mediata dal pacemaker.
- Il “comportamento della frequenza superiore” può indurre un blocco 2:1. In modalità di stimolazione bicamerale, il dispositivo stimola in modo 1:1 (A:V) fino a raggiungere la frequenza ventricolare superiore programmata. Man mano che la frequenza atriale aumenta, la stimolazione ventricolare non può violare il limite superiore della frequenza, con il risultato di intervalli AV progressivamente più lunghi. Quando l’intervallo AV si allunga, può svilupparsi un brusco blocco 2:1 con un improvviso rallentamento della frequenza ventricolare (la frequenza ventricolare diventa la metà della massima frequenza di tracciamento), inducendo sintomi.
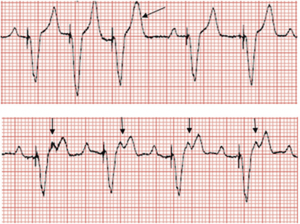
Comportamento della frequenza superiore in un pacemaker a doppia camera: Con un aumento della frequenza sinusale superiore a 130 bpm, alcune delle onde P cadono nel periodo PVARP (frecce) e non vengono tracciate. Il prolungamento progressivo della PR è visto prima dei battiti bloccati (pacemaker Wenckebach). Quando la frequenza sinusale raggiunge il TARP (intervallo AV + PVARP), ogni altra onda P cade nel PVARP e non viene tracciata, risultando in una frequenza ventricolare effettiva di 75 bpm, e un brusco calo della frequenza cardiaca (tasso di blocco 2:1 in questo paziente). Queste non sono onde p retrograde.
- Un “runaway pacemaker” comporta una disfunzione del generatore del pacemaker. Il ritmo del pacing è superiore al limite superiore programmato (fino a 400 bpm). Utilizzare magneti clinici per interrompere l’aritmia. L’ultima risorsa è quella di scollegare gli elettrocateteri dal generatore di impulsi (tagliando la tasca).
- La sindrome di Twiddler si verifica quando i pazienti disturbano/sconnettono gli elettrocateteri manipolando il generatore. Una CXR mostrerà la torsione degli elettrocateteri intorno al generatore. La correzione chirurgica è necessaria.
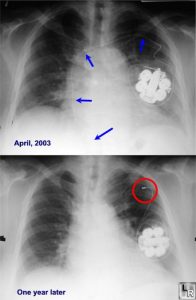
Guarda questo post su Learning Radiology: http://learningradiology.com/archives05/COW%20141-Twiddlers%20Syndrome/twiddlerscorrect.htm
- La sindrome del pacemaker descrive i sintomi anomali del paziente (dispnea, vertigini, dolore al petto, palpitazioni) dopo aver escluso tutte le altre cause di malfunzionamento del pacemaker. Comune ai pacemaker a camera singola, si pensa che sia dovuto a un rapporto di depolarizzazione anormale tra atri e ventricoli, o dissincronia AV. Correggere ottimizzando le modalità di stimolazione/programmazione.
- L’uso della risonanza magnetica in pazienti con pacemaker è controindicato dato il rischio di innescare il pacing ad alta frequenza . I pacemaker CMR condizionati sono specificamente progettati per essere sicuri in un ambiente MR, ma questi rappresentano la grande minoranza dei dispositivi. CMR-condizionale dispositivi hanno minimo materiale ferromagnetico, alterato filtraggio, e ridisegnato conduttori di piombo per ridurre al minimo l’induzione di corrente e riscaldamento del tessuto.
Considerazioni aggiuntive:
- I pazienti possono presentarsi al pronto soccorso subito dopo il posizionamento del pacemaker con dolore e gonfiore al sito della tasca.
- Il sanguinamento nella tasca è una complicazione comune e può dissecare i piani fasciali. Grandi ematomi richiedono l’evacuazione chirurgica. Non aspirare!
- Eritema, edema, fluttuazione e deiscenza del sito di incisione sono suggestivi di infezione. La maggior parte delle infezioni sono causate da S. aures e S. epidermidis, quindi la copertura empirica con vancomicina dovrebbe essere avviata in ED.
- Le infezioni che insorgono più tardi tendono a colpire gli elettrocateteri dei pacemaker. Sospettare una batteriemia, vegetazioni di elettrocateteri ed emboli polmonari settici. Confermare la diagnosi con emocolture e TEE. La vancomicina è di nuovo l’antibiotico di scelta, poiché i batteri causali tendono ad essere gram positivi. La terapia definitiva comprende l’estrazione chirurgica del piombo.
- Il posizionamento del pacemaker può anche portare a versamenti pericardici, pneumotorace ed emotorace. Aspettatevi queste presentazioni intorno alle 48 ore dopo la procedura con lamentele di dispnea, dolore toracico ed enfisema sottocutaneo.
- Il posizionamento dell’elettrocatetere attraverso la valvola tricuspide può provocare una disfunzione della valvola.
- I pacemaker possono anche migrare verso piani fasciali più superficiali a causa di traumi, ematomi o ischemia dei tessuti locali. Tale migrazione può causare l’erosione della parete della tasca, rendendo necessario lo sbrigliamento chirurgico e il trasferimento.
- Poiché gli elettrocateteri entrano nella SVC, le TVP possono svilupparsi subito dopo l’inserimento o anni dopo l’impianto. La sindrome SVC secondaria alla trombosi venosa è stata riportata.
- I TEV possono anche aumentare il rischio di ipertensione polmonare e ictus nei casi di forame ovale pervio.
- Il trattamento è l’anticoagulazione precoce, ma l’elettrocatetere di solito non viene rimosso perché così facendo potrebbe causare l’estensione del trombo.
- Lo spostamento dell’elettrocatetere e la migrazione dall’interfaccia miocardica sono complicazioni comuni nei primi 1-2 giorni dopo l’impianto. L’aderenza fibrinosa dell’elettrocatetere dopo l’impianto tende a prevenire il dislocamento tardivo. Tuttavia, il rischio rimane dato lo stress meccanico ripetitivo di ogni ciclo cardiaco e il movimento del cingolo della spalla.
- Cercare gli elettrocateteri dislocati su CXR nel seno coronarico, LV, IVC, SVC, arteria polmonare, o nell’atrio fuori dall’appendice.
- La dislocazione dell’elettrocatetere può anche causare trombosi della vena polmonare, perforazione miocardica e disritmie.
- La malposizione dell’elettrocatetere può causare la stimolazione del nervo frenico con conseguente eccitazione diaframmatica e singhiozzo intrattabile. È stata riportata una maggiore incidenza di stimolazione diaframmatica con pacemaker di risincronizzazione.
- Molte di queste preoccupazioni possono essere mitigate nel prossimo futuro con l’avvento di pacemaker senza fili che comprimono i sistemi a singolo componente in una piccola capsula che risiede all’interno del cuore.
Applicazione di un magnete clinico a un pacemaker:
Il posizionamento di un magnete clinico su un pacemaker fa sì che il dispositivo vada in una modalità asincrona, tipicamente VOO o DOO. Questo si traduce in un ritmo costante indipendentemente dalla frequenza o dal ritmo nativo. I magneti clinici di solito hanno una forza di ≥90 Gauss, ben oltre i 10 Gauss necessari per alterare il funzionamento del dispositivo. Se l’applicazione del magnete non produce alcuna risposta su un ECG anche dopo il riposizionamento, considerare l’esaurimento della batteria, considerare l’aggiunta di un secondo magnete, e considerare che il pacemaker può essere programmato per ignorare il magnete .
Questa funzione è utile per valutare l’acquisizione del pacemaker e valutare la durata della batteria. Il guasto della batteria può essere escluso se i complessi di stimolazione non presenti sull’ECG di base appaiono quando viene applicato il magnete. Un magnete può anche essere usato per interrompere una tachicardia mediata dal pacemaker. Inoltre, quando oversensing è pensato per essere la causa di una bradicardia instabile, un magnete può essere posizionato sulla parte superiore del dispositivo pacemaker per cambiare le sue impostazioni eliminando così qualsiasi funzionalità di rilevamento e permettendo di stimolazione ad un tasso predeterminato (di solito 60-80 bpm). Negli individui obesi, può essere necessario più di un magnete.
Infine, ad eccezione dei pacemaker Sorin, la rimozione del magnete fa sì che il dispositivo torni a stimolare alla normale frequenza preprogrammata.
Per ulteriori FOAMed guardate questo post su Pacemaker Basics a REBEL EM: http://rebelem.com/pacemaker-basics/
- Allison, Michael G., e H. A. Mallemat. Emergency Care of Patients with Pacemakers and Defibrillators. Cliniche di medicina d’emergenza del Nord America. 2015. 33(3). 653-667.
- Cardall, Taylor Y., et al. Pacemaker cardiaci permanenti: Issues Relevant to the Emergency Physician, Part I. The Journal of Emergency Medicine. 1999. 17(3). 479-489.
- Eifling, Michael, M. Razavi, e A. Massumi. La valutazione e la gestione della tempesta elettrica. Texas Heart Institute Journal. 2011. 38(2). 111-121.
- Jacob, Sony, et al. Algoritmo di identificazione del dispositivo di ritmo cardiaco utilizzando i raggi X: CaRDIA-X. Società del ritmo cardiaco. 2011. 8(6). 915-922.
- Jacob, Sony, et al. Applicazioni cliniche dei magneti sui dispositivi di gestione del ritmo cardiaco. Europace. 2011. 13. 1222-1230.
- Madhavan, Malini, et al. Advances and Future Directions in Cardiac Pacemakers. Journal of the American College of Cardiology. 2017. 69(2). 211-235.
- McMullan, Jason, et al. Care of the Pacemaker/Implantable Cardioverter Defibrillator in the ED. Giornale americano di medicina d’emergenza. 2007. 25. 812-822.
- Mulpuru, Siva, et al. Pacemaker cardiaci: Funzione, risoluzione dei problemi e gestione. Journal of the American College of Cardiology. 2017. 69(2). 189-210.