Medikamenten-induzierte Hypertonie
US Pharm. 2008;33(9):HS11-HS20.
Pharmazeuten erhalten häufig Anfragen zu den Auswirkungen von Medikamenten auf den Blutdruck. Beispielsweise gibt es immer noch Bedenken zu rezeptfreien Husten- und Erkältungsmitteln, obwohl einige Inhaltsstoffe, wie Phenylpropanolamin, vom US-Markt genommen wurden. Obwohl nur wenige Medikamentenklassen einen klinisch signifikanten Anstieg des arteriellen Blutdrucks verursachen, sollten Apotheker auf Medikamente achten, die eine effektive Blutdruckkontrolle beeinträchtigen können. Eine Übersicht über die Wechselwirkungen von Medikamenten mit blutdrucksenkenden Mitteln würde den Rahmen dieses Artikels sprengen. Es werden jedoch einige der häufigsten Beispiele für arzneimittelinduzierte Hypertonie diskutiert (TABELLE 1). Medikamenteninduzierte Blutdruckerhöhungen stellen eine wichtige und modifizierbare Ursache für sekundäre Hypertonie dar; daher ist es zwingend erforderlich, dass Apotheker diesen kausalen Zusammenhang erkennen.
Sympathomimetika
Es ist bekannt, dass sympathomimetische Amine dosisabhängige Blutdruckerhöhungen verursachen.1-4 Während die durch Sympathomimetika induzierte Hypertonie bei gesunden Patienten klinisch nicht signifikant ist, kann sie bei anderen gefährlich werden.1-4 Zu den sympathomimetischen Aminen gehören Amphetamine und ähnliche Verbindungen, wie Pseudoephedrin, Phenylpropanolamin und Ephedrin. In der Vergangenheit waren diese Verbindungen in einigen rezeptfreien Husten- und Erkältungspräparaten enthalten. Da die Verwendung von Phenylpropanolamin mit Bluthochdruck und Schlaganfall in Zusammenhang gebracht wurde, hat die FDA es im November 2000 vom Markt genommen.3,4
Pseudoephedrin: Pseudoephedrin ist ein bronchienerweiterndes und nasales Vasokonstriktorikum, das im Allgemeinen harmlos ist, wenn es in den empfohlenen Dosen verwendet wird. Aufgrund seines Missbrauchspotenzials beschränken viele Einzelhändler den Verkauf von Pseudoephedrin jedoch auf den Verkauf hinter dem Ladentisch. Pseudoephedrin wird häufig zur Behandlung von Symptomen der Rhinitis und Rhinorrhoe verwendet, aber seine Auswirkungen auf den Blutdruck und die Herzfrequenz bleiben ungewiss. Aufgrund seiner pharmakologischen Ähnlichkeit mit Ephedrin und Phenylpropanolamin wird die Verwendung von Pseudoephedrin bei hypertensiven Patienten ebenfalls vermieden.
Salerno et al. untersuchten, ob Pseudoephedrin klinisch bedeutsame Erhöhungen des Blutdrucks und der Herzfrequenz verursacht.5 In dieser Meta-Analyse wurden als primäre Daten der systolische und diastolische Blutdruck und die Herzfrequenz extrahiert. Vierundzwanzig klinische Studien hatten extrahierbare Vitalparameter-Informationen und schlossen insgesamt 1.285 Patienten ein. Die Analyse zeigte, dass Pseudoephedrin einen geringen mittleren Anstieg des systolischen Blutdrucks (ca. 1 mmHg) verursacht, ohne signifikante Auswirkung auf den diastolischen Blutdruck, und einen leichten Anstieg der Herzfrequenz (etwa 3 Schläge pro Minute). Formulierungen mit sofortiger Wirkstofffreisetzung hatten eine größere Wirkung als Formulierungen mit verzögerter Wirkstofffreisetzung, was aufgrund der Pharmakokinetik zu erwarten wäre. Bei den Formulierungen mit sofortiger Wirkstofffreisetzung kam es zu einem dosisabhängigen Anstieg aller drei kardiovaskulären Variablen. Mit steigender Pseudoephedrin-Dosis wurde ein stärkerer Anstieg des systolischen und diastolischen Blutdrucks beobachtet. Frauen schienen für die kardiovaskulären Effekte etwas weniger anfällig zu sein als Männer. Bei Patienten, deren Hypertonie stabil und kontrolliert war, erhöhte die Pseudoephedrin-Therapie den systolischen Blutdruck, hatte aber keinen Einfluss auf den diastolischen Druck. Es gab keinen Effekt auf die Herzfrequenz bei den behandelten Hypertonikern, was jedoch daran liegen könnte, dass viele Patienten Betablocker erhielten. Es wurden keine klinisch bedeutsamen unerwünschten Ereignisse wie hypertensive Notfälle, Schlaganfall oder Arrhythmie dokumentiert. Andere Forscher kamen ebenfalls zu dem Schluss, dass Pseudoephedrin in Standarddosen keinen klinisch signifikanten Effekt auf den systolischen oder diastolischen Blutdruck bei Patienten mit kontrolliertem Bluthochdruck hat.6
Apotheker sollten ihre Patienten darauf hinweisen, dass Pseudoephedrin den Blutdruck und die Herzfrequenz geringfügig erhöhen kann. Diese Effekte sind am stärksten bei Formulierungen mit sofortiger Freisetzung, höheren Dosen und kurzfristiger Medikamenteneinnahme. Patienten mit stabilem, kontrolliertem Bluthochdruck scheinen im Vergleich zu Patienten ohne Bluthochdruck kein höheres Risiko für eine Blutdruckerhöhung zu haben. Man kann jedoch nicht vorhersagen, wie jeder einzelne Patient reagieren wird. Das Nutzen-Risiko-Verhältnis sollte sorgfältig abgewogen werden, bevor ein Sympathomimetikum bei Personen mit Bluthochdruck eingesetzt wird. Apotheker sollten Patienten mit kardiovaskulären Erkrankungen anweisen, ihren Blutdruck nach Beginn der Einnahme von pseudoephedrinhaltigen Medikamenten sorgfältig zu überwachen. Produkte mit verzögerter Wirkstofffreisetzung sind im Allgemeinen zu bevorzugen, um einen Anstieg des Blutdrucks zu vermeiden. Alternativ können intranasale abschwellende Mittel wie Oxymetazolin verwendet werden, da diese bei Verwendung der empfohlenen Dosierung nachweislich keinen Bluthochdruck auslösen.7
Amphetamin-Derivate: Eine Reihe von Medikamenten, die bei Narkolepsie und Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung eingesetzt werden, sind chemisch mit Amphetamin verwandt. Zu diesen Stimulanzien des zentralen Nervensystems (ZNS) gehören Dextroamphetamin, Methamphetamin und Methylphenidat. Die FDA hat kürzlich eine Warnung für Dextroamphetamin herausgegeben, die besagt, dass die Anwendung von ZNS-Stimulanzien in üblichen Dosen bei Kindern und Jugendlichen mit schweren Herzproblemen und strukturellen Herzanomalien mit plötzlichem Tod in Verbindung gebracht wurde.8 Unerwünschte kardiovaskuläre Ereignisse, die durch Stimulanzien ausgelöst werden, sind jedoch nicht auf Kinder beschränkt. Auch bei Erwachsenen mit bekannter Herzerkrankung wurde ein erhöhtes Risiko für einen plötzlichen Tod bei der Einnahme von Stimulanzien in normalen Dosen festgestellt. Generell sollten amphetaminähnliche Substanzen (d. h. ZNS-Stimulanzien) bei Patienten mit bekannten schweren strukturellen Herzanomalien, Kardiomyopathie, schweren Herzrhythmusstörungen oder anderen schweren Herzproblemen, die das Risiko eines plötzlichen Todes erhöhen, vermieden werden. Erhöhungen der Herzfrequenz und des Blutdrucks wurden bei Kindern beobachtet, die Medikamente dieser Klasse erhielten.9 Daher sollte dieses potenzielle kardiovaskuläre Risiko gegen die vorteilhaften Verhaltenseffekte dieser Medikamente abgewogen werden.
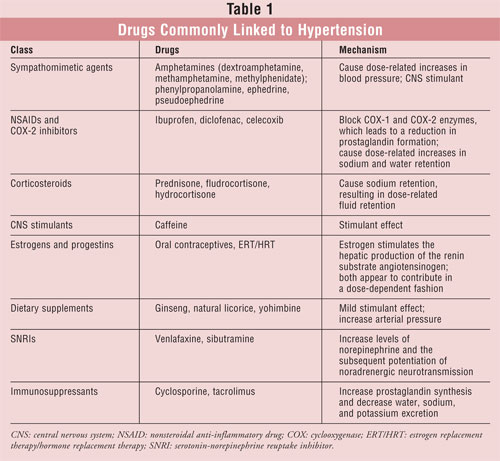
NSAIDs und COX-2-Hemmer
Nonsteroidale Antirheumatika (NSAIDs) haben potenziell schädliche Auswirkungen auf den Blutdruck.10,11 NSAIDs blockieren sowohl die Enzyme Cyclooxygenase-1 (COX-1) als auch COX-2, was zu einer Reduzierung der Prostaglandinbildung führt. Diese Medikamente können je nach Patientenkontext weitreichende nützliche und schädliche Auswirkungen haben. Die arzneimittelinduzierte Hypertonie im Zusammenhang mit NSAIDs ist auf die renalen Effekte dieser Medikamente zurückzuführen. Insbesondere verursachen NSAIDs einen dosisabhängigen Anstieg der Natrium- und Wasserretention. Dieser Effekt wird auch bei COX-2-selektiven Wirkstoffen wie Celecoxib beobachtet.11
Die COX-1- und COX-2-Isoformen werden beide in der normalen erwachsenen Niere exprimiert, wobei COX-1 im Glomerulus und der afferenten Arteriole und COX-2 in der afferenten Arteriole, den Podozyten und der Macula densa vorkommt.12 Die spezifische Lokalisierung jedes dieser Isoenzyme in der Niere führt zu deutlich unterschiedlichen Auswirkungen auf die Nierenfunktion. Die von COX-1 produzierten Prostaglandine beeinflussen primär die renale Homöostase, indem sie die Vasodilatation im renalen Gefäßbett fördern, den renalen Gefäßwiderstand reduzieren und folglich die renale Perfusion erhöhen. Die vom COX-2-Isoenzym produzierten Prostaglandine haben diuretische und natriuretische Wirkungen.12,13 Bei hämodynamisch beeinträchtigten Patienten sind die Wirkungen der beiden Isoenzyme aufgrund ihrer vasodilatatorischen Effekte für die Aufrechterhaltung der Nierendurchblutung von wesentlicher Bedeutung. Da NSAIDs die Produktion der Prostaglandine COX-1 und COX-2 blockieren, sind renale Nebenwirkungen nicht ungewöhnlich und treten bei ca. 1 % bis 5 % der NSAID-Anwender auf.13
Durch die Hemmung der natriuretischen Wirkung von COX-2 und die dadurch erhöhte Natriumretention bergen alle NSAIDs das Risiko einer erhöhten Flüssigkeitsretention.14 Zusätzlich kann die Hemmung von gefäßerweiternden Prostaglandinen und die Produktion von gefäßverengenden Faktoren, nämlich Endothelin-1, zur Induktion von Bluthochdruck bei einem normotensiven und/oder kontrollierten hypertensiven Patienten beitragen.14
In einem Vergleich von Celecoxib mit Diclofenac, der bei 287 Patienten mit Arthritis durchgeführt wurde, wurden bei 79 Patienten (27,8 %) kardiovaskuläre und renale Nebenwirkungen beobachtet, wobei Hypertonie am häufigsten auftrat (16,6 %).14 Es gab keinen statistischen Unterschied in der Inzidenz von Hypertonie zwischen der traditionellen NSAR- und der COX-2-Gruppe. Diese Auslösung von Bluthochdruck durch NSAIDs ist in der Diskussion um die Sicherheit von COX-2 besonders wichtig, da der hypertensive Status ein wichtiger Risikofaktor für das Fortschreiten praktisch aller kardiovaskulären Erkrankungen ist, einschließlich Schlaganfall, Herzinfarkt und Herzinsuffizienz.15
Vor kurzem wurde eine Meta-Analyse zu COX-2-Hemmern und ihren Auswirkungen auf den Blutdruck veröffentlicht.16 Die Daten wurden bei 45.451 Patienten aus 19 klinischen Studien erhoben. Interessanterweise schien es eine etwas stärkere Blutdruckerhöhung mit COX-2-Hemmern im Vergleich zu Placebo und nicht-selektiven NSAIDs (z. B. Ibuprofen und Diclofenac) zu geben. Rofecoxib schien im Vergleich zu Celecoxib ein größeres Risiko für die Entwicklung klinisch bedeutsamer Erhöhungen sowohl des systolischen als auch des diastolischen Blutdrucks mit sich zu bringen. Rofecoxib wurde jedoch 2004 aufgrund von Bedenken über ein erhöhtes Risiko für Herzinfarkt und Schlaganfall freiwillig vom Markt genommen.17
Aufgrund der weit verbreiteten Verfügbarkeit von NSAIDs ohne Rezept sind viele Patienten mit Bluthochdruck möglicherweise dem Risiko ausgesetzt, dass diese Medikamente den Blutdruck verschlimmern. Apotheker sollten eine sorgfältige Medikamentenanamnese erheben und speziell nach der rezeptfreien Einnahme von NSAIDs fragen. Patienten mit Bluthochdruck sollten bei der Verwendung von NSAIDs genauer auf Blutdruckerhöhungen überwacht werden. Die Patienten sollten darüber aufgeklärt werden, dass diese unerwünschte Wirkung in der Regel dosisabhängig ist, aber nicht immer vorhersehbar ist. Die unerwünschte Wirkung aller NSAIDs und COX-2-Hemmer auf den Blutdruck hat möglicherweise die größte klinische Bedeutung bei älteren Menschen, bei denen die Prävalenz von Arthritis, Bluthochdruck und NSAID-Einsatz hoch ist.18
Kortikosteroide
Alle Kortikosteroid-Medikamente, einschließlich Prednison, können eine Natriumretention verursachen, was zu einer dosisabhängigen Flüssigkeitsretention führt.19 Kortikosteroide mit starker Mineralokortikoid-Wirkung, wie Fludrocortison und Hydrocortison, erzeugen die größte Menge an Flüssigkeitsretention. Einige Kortikosteroide ohne signifikante Mineralokortikoid-Wirkung (z. B. Dexamethason, Triamcinolon, Betamethason) können jedoch eine geringere Flüssigkeitsretention hervorrufen.20 Die kortikosteroid-induzierte Flüssigkeitsretention kann schwer genug sein, um Bluthochdruck zu verursachen, und bei Patienten mit vorbestehendem Bluthochdruck kann es zu einer Verschlechterung der Blutdruckkontrolle kommen, wenn diese Medikamente eingesetzt werden. Der Hauptmechanismus der Kortikosteroid-induzierten Hypertonie ist die Überstimulation des Mineralokortikoidrezeptors, was zu einer Natriumretention in der Niere führt. Dies führt zu einer Volumenexpansion und einem anschließenden Anstieg des Blutdrucks. Kortikosteroid-induzierte Hypertonie kann auf eine diuretische Therapie ansprechen.21 Es sollte die kleinste wirksame Dosis und die kürzeste Dauer der Steroidtherapie verwendet werden, um die Entwicklung dieser unerwünschten Wirkung zu verringern.
Fludrocortison bewirkt einen signifikanten Blutdruckanstieg und ist daher zur Behandlung von Patienten mit posturaler Hypotonie geeignet. In einer Studie mit 64 älteren Patienten, die über einen Zeitraum von etwa fünf Monaten eine durchschnittliche Dosis von 75 mcg Fludrocortison erhielten, mussten vier Patienten wegen medikamenteninduzierter Hypertonie abgesetzt werden.22 Die Untersucher der Studie kamen zu dem Schluss, dass die Fludrocortison-Therapie bei älteren Patienten schlecht verträglich ist, selbst bei niedrigen Dosen.
Koffein
Die Auswirkungen von Koffein auf die Blutdruckkontrolle sind nicht gut definiert. Kürzlich wurde eine Meta-Analyse von randomisierten, kontrollierten Studien veröffentlicht, die die Wirkung von Kaffee oder Koffein allein auf die Blutdruckwerte untersuchten.23 Insgesamt wurden 16 Studien mit randomisierten, kontrollierten Designs ausgewählt, die 1.010 Probanden repräsentierten. Nach der Zusammenfassung dieser Studien wurde ein Anstieg des systolischen Blutdrucks um 2,04 mmHg und des dia-stolischen Blutdrucks um 0,73 mmHg festgestellt. Bei der getrennten Analyse der Kaffee- und Koffeinstudien waren die induzierten Blutdruckerhöhungen mit Koffein (410 mg/Tag) größer als mit Kaffee (725 ml/Tag). Die Auswirkungen von Kaffee und Koffein auf die Herzfrequenz waren nicht signifikant.
Östrogene und Gestagene
Die chronische Einnahme von oralen Kontrazeptiva kann bei bestimmten Frauen zu einer leichten Erhöhung des Blutdrucks führen und andere nachteilige Auswirkungen auf das kardiovaskuläre Risiko haben. Frühe epidemiologische Studien mit hochdosiertem Östrogen ergaben mittlere Blutdruckerhöhungen von 3 bis 6 mmHg systolisch und 2 bis 5 mmHg diastolisch, wobei etwa 5 % der Frauen einen neuen Bluthochdruck entwickelten.24 Dies war wahrscheinlicher bei Patientinnen, die bereits zuvor während einer Schwangerschaft einen Bluthochdruck entwickelt hatten oder bei solchen mit einer familiären Vorgeschichte von Bluthochdruck. Obwohl der Blutdruckanstieg in der Regel leicht ist, kann es zu einer malignen Hypertonie kommen.25 Die größte Sorge bei einem durch orale Kontrazeptiva induzierten Blutdruckanstieg ist die Entwicklung einer persistierenden Hypertonie und einer nachfolgenden vorzeitigen kardiovaskulären Erkrankung, insbesondere bei Frauen, die rauchen. Das Absetzen der Therapie führt typischerweise zu einer Rückkehr zum Ausgangsblutdruck innerhalb von zwei bis 12 Monaten, aber die Proteinurie kann persistieren.25,26
Die Mechanismen, die für die hypertensive Wirkung der oralen Kontrazeptiva verantwortlich sind, sind nur unzureichend verstanden. Möglicherweise ist das Renin-Angiotensin-System beteiligt, da Östrogen die hepatische Produktion des Renin-Substrats Angiotensinogen stimuliert.27 Sowohl Östrogen als auch Progesteron scheinen dosisabhängig zu wirken. Die oft zitierte Häufigkeit von Bluthochdruck in Verbindung mit Östrogen in Höhe von 5 % stammt aus Studien mit hochdosierter Therapie, in denen die Östrogendosis mindestens 50 mcg und die Gestängedosis 1 bis 4 mg betrug.24 Heutige Präparate enthalten jedoch nur noch 20 % der in früheren Präparaten verwendeten Menge an Östrogen und Gestagen. Ein Bericht der Nurses‘ Health Study untersuchte prospektiv fast 70.000 Krankenschwestern im Alter von 25 bis 42 Jahren.28 Nach Adjustierung für Alter, Gewicht, Rauchen, Familienanamnese und andere Risikofaktoren betrug das relative Risiko für Bluthochdruck bei den Krankenschwestern im Vergleich zu Frauen, die nie orale Kontrazeptiva verwendet hatten, 1,8 für aktuelle Anwenderinnen und 1,2 für frühere Anwenderinnen. Insgesamt konnten nur 41,5 Fälle von Bluthochdruck pro 10.000 Personenjahre auf die Einnahme oraler Kontrazeptiva zurückgeführt werden, und diese Zahl nahm nach Beendigung der Therapie rasch ab. In einer Meta-Analyse von 14 Studien, die zwischen 1980 und 2003 veröffentlicht wurden, stieg das relative Risiko für Schlaganfall und Herzinfarkt bei aktuellen Anwenderinnen oraler Kontrazeptiva (<50 mcg Ethinylestradiol täglich) um das Zweifache an.29
Die postmenopausale Östrogenersatztherapie (ERT) oder die Hormonersatztherapie (HRT) in Kombination mit Gestagen besteht aus viel niedrigeren Östrogendosierungen als die der oralen Kontrazeptiva. ERT und HRT scheinen einen neutralen Effekt auf den Blutdruck zu haben, wie die folgenden Beobachtungen aus zwei großen randomisierten Studien zeigen. Die Women’s Health Initiative (WHI) ist die größte (N = 16.000) randomisierte, placebokontrollierte Studie, die den Effekt einer Östrogen-Gestagen-Substitution auf die Ergebnisse bei postmenopausalen Frauen untersucht hat.30 Nach 5,2 Jahren führte die HRT im Vergleich zu Placebo nur zu einem geringen Anstieg (1,5 mmHg) des systolischen Drucks. Ähnliche Ergebnisse wurden in der PEPI-Studie festgestellt, in der die ERT, mit oder ohne Gestagene, nach drei Jahren keinen Einfluss auf den Blutdruck hatte.31
Weitere Studien, an denen weniger Frauen teilnahmen, fanden eine Verringerung des ambulanten Blutdrucks und einen stärkeren Rückgang des nächtlichen Drucks bei ERT-Anwenderinnen.32,33 Es ist möglich, dass die HRT den Anstieg des systolischen Drucks über einen längeren Behandlungszeitraum verlangsamt.34 Aufgrund des signifikanten Anstiegs des Risikos für Koronarerkrankungen, Schlaganfälle und venöse Thromboembolien, der in der WHI-Studie nachgewiesen wurde, wird die HRT jedoch nicht mehr zum Schutz des Herz-Kreislauf-Systems empfohlen.35
Nahrungsergänzungsmittel
Ginseng ist allgemein als sicher anerkannt und wurde mit wenigen ernsthaften Nebenwirkungen in Verbindung gebracht. Da er eine leicht stimulierende Wirkung haben kann, ist bei der Verwendung mit anderen Stimulanzien bei Patienten mit kardiovaskulären Erkrankungen Vorsicht geboten. Eine Art von Ginseng-Missbrauchssyndrom, das durch Durchfall, Bluthochdruck, Nervosität, dermatologische Ausbrüche und Schlaflosigkeit gekennzeichnet ist, wurde beschrieben.36 Dieses Syndrom kann nach einzelnen hohen Dosen oder längerem Gebrauch auftreten. Andere Nahrungsergänzungsmittel, die den arteriellen Druck erhöhen können, sind natürliches Süßholz und Yohimbin.37 Generell sollten alle Patienten mit Bluthochdruck die Einnahme von Nahrungsergänzungsmitteln vorher mit ihrem Apotheker oder Arzt besprechen. Die Auswirkungen der meisten Nahrungsergänzungsmittel auf den Blutdruck sind nicht ausreichend charakterisiert.
Serotonin-Norepinephrin-Wiederaufnahmehemmer
Venlafaxin: Venlafaxin ist ein Serotonin-Norepinephrin-Wiederaufnahmehemmer (SNRI), der zur Behandlung von Depressionen und Angststörungen eingesetzt wird. Der wahrscheinliche Mechanismus der Venlafaxin-induzierten Hypertonie ist die Erhöhung des Noradrenalinspiegels und die anschließende Potenzierung der noradrenergen Neurotransmission.38 Die Formulierung mit verlängerter Wirkstofffreisetzung von Venlafaxin erhöht den Blutdruck bei etwa 3 % der Patienten, wenn normale Dosen (75-150 mg) verwendet werden.38 Die Mehrzahl dieser Blutdruckerhöhungen wurde jedoch als geringfügig eingestuft. Dosen >=300 mg Venlafaxin mit verlängerter Wirkstofffreisetzung zeigten bei 13 % der Patienten klinisch signifikante Erhöhungen, wobei die Mehrzahl der Blutdruckerhöhungen zwischen 10 und 15 mmHg lag.39 Es ist jedoch wichtig zu beachten, dass die Dosierung von 300 mg oder mehr nicht üblich ist und das Risiko einer venlafaxininduzierten Hypertonie in der Regel nicht das Absetzen dieses Medikaments rechtfertigt.40
Sibutramin: Die klinische Bedeutung von Sibutramin-induziertem Bluthochdruck ist nicht gut definiert. Sibutramin ist ein SNRI und ist chemisch dem Amphetamin ähnlich. Der wahrscheinliche Mechanismus der Blutdruckerhöhung durch Sibutramin sowohl bei normotensiven als auch bei hypertensiven Patienten ist die erhöhte Menge an Noradrenalin im Körper.41 Eine klinische Studie, die die durch Sibutramin induzierten Nebenwirkungen untersuchte, zeigte eine mittlere Erhöhung des systolischen und diastolischen Blutdrucks von 2 mmHg bei zuvor normotensiven Patienten, die täglich 10 bis 15 mg Sibutramin erhielten. Interessanterweise wurde bei hypertensiven Patienten, die ähnliche Dosen erhielten, eine Erhöhung von 7 mmHg nachgewiesen.42 Andere Studien haben ähnliche Ergebnisse gezeigt.43,44 Bei Patienten mit etablierter Hypertonie, die Sibutramin erhielten, waren die Blutdruckerhöhungen signifikant höher als bei Patienten, die vor Beginn der Behandlung einen normalen Blutdruck hatten. Die Behandlung mit Sibutramin sollte wahrscheinlich auf Patienten beschränkt werden, die keine kardiovaskulären Erkrankungen haben, einschließlich Bluthochdruck, funktionelle Anomalien und koronare Herzkrankheiten.
Immunsuppressiva
Cyclosporin: Die nachteilige Wirkung von Cyclosporin auf den Blutdruck ist bekannt.45 Der genaue Mechanismus der Cyclosporin-induzierten Hypertonie ist unklar, aber es wurden mehrere Hypothesen vorgeschlagen, darunter eine erhöhte Prostaglandin-Synthese und eine verringerte Wasser-, Natrium- und Kaliumausscheidung.46,47 Bei bis zu 50 % der Nierentransplantationspatienten, die mit Cyclosporin behandelt wurden, wurde über einen erhöhten Blutdruck berichtet, und in den meisten dieser Fälle war eine Behandlung der Hypertonie erforderlich.48 Aufgrund der unerwünschten Wirkungen des Cyclosporin-Entzugs bei Transplantationspatienten und bei Patienten mit Autoimmunerkrankungen wird Cyclosporin nur selten wegen erhöhter Hypertonie abgesetzt. Die Behandlung der Cyclosporin-induzierten Hypertonie kann pharmakologisch erfolgen, möglicherweise bestehend aus Kalziumkanalblockern, Diuretika, Betablockern oder ACE-Hemmern, oder nicht-pharmakologisch, bestehend aus einer reduzierten Natriumaufnahme.45 1999 wurde eine Konsenserklärung veröffentlicht, die besagt, dass die Cyclosporin-Dosis um 25 % verringert werden sollte, wenn der systolische Blutdruck über 140 mmHg oder der diastolische Blutdruck über 90 mmHg bei zwei aufeinanderfolgenden Gelegenheiten ansteigt.48 Der Blutdruck sollte in den ersten drei Monaten der Cyclosporin-Therapie alle zwei Wochen kontrolliert werden, um auf Veränderungen zu achten.
Tacrolimus: Bei Patienten mit schwerer, therapierefraktärer Cyclosporin-induzierter Hypertonie kann ein Wechsel zu Tacrolimus eine Option sein. Tacrolimus hat, wie Cyclosporin, nachweislich einen signifikanten Einfluss auf den Blutdruck. Die Inzidenz der Tacrolimus-induzierten Hypertonie (35 %) ist jedoch geringer als die von Cyclosporin (50 %).49 Der Mechanismus der Tacrolimus-induzierten Hypertonie ist vermutlich ähnlich wie der von Cyclosporin, wie bereits erwähnt.50 Zur Behandlung der mit der Tacrolimus-Therapie assoziierten Blutdruckerhöhungen sind möglicherweise ähnliche Modifikationen erforderlich, wie sie für die Cyclosporin-induzierte Hypertonie aufgeführt sind, unabhängig davon, ob es sich um pharmakologische oder nichtpharmakologische Maßnahmen handelt.51 Während der Therapie mit Tacrolimus oder Cyclosporin ist eine sorgfältige Blutdrucküberwachung angezeigt.
Zusammenfassung
Pharmazeuten sollten sich der wichtigsten Medikamentenklassen bewusst sein, die den Blutdruck erhöhen und/oder eine effektive Blutdruckkontrolle beeinträchtigen können. Beispiele sind Sympathomimetika, NSAIDs, Östrogene, Kortikosteroide, Cyclosporin und einige Naturprodukte (z.B. Ginseng). Apotheker sollten nach Medikamenten suchen, die den Blutdruck erhöhen, und den Patienten und medizinischen Dienstleistern Rückmeldung geben, um diese mögliche Ursache für sekundären Bluthochdruck zu verringern. Generell sollten alle Patienten mit Bluthochdruck genauer überwacht werden, wenn zusätzliche Medikamente verschrieben werden, insbesondere wenn Medikamente hinzukommen, die bekanntermaßen den Blutdruck erhöhen.
1. Cantu C, Arauz A, Murillo-Bonilla LM, et al. Stroke associated with sympathomimetics contained in over-the-counter cough and cold drugs. Stroke. 2003;34:1667-1672.
2. Kernan W, Viscoli C, Brass L, et al. Phenylpropanolamine and the risk of hemorrhagic stroke. N Engl J Med. 2000;343:1826-1832.
3. Fleming GA. Die FDA, Regulierung und das Risiko eines Schlaganfalls. N Engl J Med. 2000;343:1886-1887.
4. Mersfelder TL. Phenylpropanolamin und Schlaganfall: die Studie, die FDA-Entscheidung, die Auswirkungen. Cleveland Clin J Med. 2001;68:213-219.
5. Salerno SM, Jackson JL, Berbano EP. Wirkung von oralem Pseudoephedrin auf Blutdruck und Herzfrequenz: eine Meta-Analyse. Arch Intern Med. 2005;165:1686-1694.
6. Coates ML, Rembold CM, Farr BM. Erhöht Pseudoephedrin den Blutdruck bei Patienten mit kontrollierter Hypertonie? J Fam Pract. 1995;40:22-26.
7. Bradley JG. Nicht verschreibungspflichtige Medikamente und Bluthochdruck. Which ones affect blood pressure? Postgrad Med.1991;89:195-197,201-202.
8. 2006 safety alerts for drugs, biologics, medical devices, and dietary supplements. Dexedrine (Dextroamphetamin-Sulfat). FDA. August 21, 2006. www.fda.gov/medwatch/safety/2006/safety06.htm#Dexedrine. Accessed May 13, 2008.
9. Samuels JA, Franco K, Wan F, Sorof JM. Wirkung von Stimulanzien auf den ambulanten 24-Stunden-Blutdruck bei Kindern mit ADHS: eine doppelblinde, randomisierte Cross-over-Studie. Pediatr Nephrol. 2006;21:92-95.
10. Howard PA, Delafontaine P. Nonsteroidal anti-inflammatory drugs and cardiovascular risk. J Am Coll Cardiol. 2004;43:519-525.
11. Armstrong EP, Malone DC. The impact of nonsteroidal anti-inflammatory drugs on blood pressure, with an emphasis on newer agents. Clin Ther. 2003;25:1-18.
12. Schnitzer TJ. Cyclooxygenase-2-spezifische Inhibitoren: sind sie sicher? Am J Med. 2001;110:46S-49S.
13. DeMaria AN, Weir MR. Coxibs – beyond the GI tract: renal and cardiovascular issues. J Pain Symptom Manage. 2003;25(suppl 2):S41-S49.
14. Stollberger C, Finsterer J. Side effects of conventional nonsteroidal anti-inflammatory drugs and celecoxib: more similarities than differences. South Med J. 2004;97:209.
15. Fitzgerald GA. Coxibs and cardiovascular disease. N Eng J Med. 2004;351:1709-1711.
16. Aw TJ, Haas SJ, Liew D, Krum H. Meta-analysis of COX-2 inhibitors and their effects on blood pressure. Arch Intern Med. 2005;165:490-496.
17. Merck kündigt freiwillige weltweite Rücknahme von VIOXX an. 30. September 2004. www.merck.com/newsroom/vioxx/pdf/vioxx_press_release_final.pdf. Accessed May 13, 2008.
18. de Leeuw PW. Drug-induced hypertension. Recognition and management in older patients. Drugs Aging. 1997;11:178-185.
19. Clyburn EB, DiPette DJ. Hypertonie induziert durch Medikamente und andere Substanzen. Semin Nephrol. 1995;15:72-86.
20. Hari P, Bagga A, Mantan M. Short term efficacy of intravenous dexamethasone and methylprednisolone therapy in steroid resistant nephrotic syndrome. Indian Pediatr. 2004;41:993-1000.
21. Ferrari P. Cortisol and the renal handling of electrolytes: role in glucocorticoid-induced hypertension and bone disease. Best Pract Res Clin Endocrinol Metab. 2003;17:575-589.
22. Hussain RM, McIntosh SJ, Lawson J, et al. Fludrocortison in the treatment of hypotensive disorders in the elderly. Heart. 1996;76:507-509.
23. Noordzij M, Uiterwaal CS, Arends LR, et al. Blood pressure response to chronic intake of coffee and caffeine: a meta-analysis of randomized controlled trials. J Hypertens. 2005;23:921-928.
24. Woods JW. Orale Kontrazeptiva und Hypertonie. Hypertension. 1988;11:II11-II15.
25. Lim KG, Isles CG, Hodsman GP. Maligne Hypertonie bei Frauen im gebärfähigen Alter und ihr Zusammenhang mit der Antibabypille. Br Med J (Clin Res Ed). 1987;294:1057-1059.
26. Ribstein J, Halimi JM, du Cailar G, Mimran A. Renal characteristics and effect of angiotensin suppression in oral contraceptive users. Hypertension. 1999;33:90-95.
27. Goldhaber SZ, Hennekens CH, Spark RF, et al. Plasma renin substrate, renin activity, and aldosterone levels in a sample of oral contraceptive users from a community survey. Am Heart J. 1984;107:119-122.
28. Chasan-Taber L, Willett WC, Manson JE, et al. Prospective study of oral contraceptives and hypertension among women in the United States. Circulation. 1996;94:483-489.
29. Baillargeon JP, McClish DK, Essah PA, Nestler JE. Assoziation zwischen der aktuellen Verwendung von niedrig dosierten oralen Kontrazeptiva und kardiovaskulärer Arterienerkrankung: eine Meta-Analyse. J Clin Endocrinol Metab. 2005;90:3863-3870.
30. Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA. 2002;288:321-333.
31. Auswirkungen von Östrogen- oder Östrogen/Progestin-Kombinationen auf Risikofaktoren für Herzerkrankungen bei postmenopausalen Frauen. The Postmenopausal Estrogen/Progestin Interventions (PEPI) Trial. JAMA. 1995;273:199-208.
32. Butkevich A, Abraham C, Phillips RA. Hormonersatztherapie und 24-Stunden-Blutdruckprofil bei postmenopausalen Frauen. Am J Hypertens. 2000;13:1039-1041.
33. Cagnacci A, Rovati L, Zanni A, et al. Physiological doses of estradiol decrease nocturnal blood pressure in normotensive postmenopausal women. Am J Physiol.1999;276:H1355-H1360.
34. Scuteri A, Bos AJ, Brant LJ, et al. Hormonersatztherapie und longitudinale Veränderungen des Blutdrucks bei postmenopausalen Frauen. Ann Intern Med. 2001;135:229-238.
35. Bath PM, Gray LJ. Assoziation zwischen Hormonersatztherapie und nachfolgendem Schlaganfall: eine Meta-Analyse. BMJ. 2005;330:342.
36. Chen KJ. Die Wirkung und das Missbrauchssyndrom von Ginseng. J Trad Chin Med. 1981;1:69-72.
37. Pittler MH, Schmidt K, Ernst E. Adverse events of herbal food supplements for body weight reduction: systematic review. Obes Rev. 2005;6:93-111.
38. Thase ME. Auswirkungen von Venlafaxin auf den Blutdruck: eine Meta-Analyse der Originaldaten von 3744 depressiven Patienten. J Clin Psychiatry. 1998;59:502-508.
39. Effexor XR (Venlafaxin HCl) package insert. Philadelphia, PA: Wyeth Pharmaceuticals; Februar 2008.
40. Venlafaxin: eine neue Dimension in der antidepressiven Pharmakotherapie. J Clin Psychiatr. 1993;54:119-126.
41. Mager ME. Sibutramine: a review of clinical efficacy. Int J Obes Relat Metab Disord. 1997;21(suppl 1):S30-S36.
42. Weintraub M, Rubio A, Golik A, et al. Sibutramine in weight control: a dose-ranging, efficacy study. Clin Pharmacol Ther. 1991;50:330-337.
43. King DJ, Devaney N. Clinical pharmacology of sibutramine hydrochloride, a new antidepressant, in healthy volunteers. Br J Clin Pharmacol. 1988;26:607-611.
44. Perrio MJ, Wilton LV, Shakir SA. Die Sicherheitsprofile von Orlistat und Sibutramin: Ergebnisse von Verschreibungs-Event-Monitoring-Studien in England. Obesity. 2007;15:2712-2722.
45. Vercauteren SB, Bosmans JL, Elseviers MM, et al. A meta-analysis and morphological review of cyclosporine-induced nephrotoxicity in auto-immune diseases. Kidney Int. 1998;54:536-545.
46. Kutkuhn B, Hollenbeck M, Heering P, et al. Entwicklung von Insulinresistenz und erhöhtem Blutdruck während der Therapie mit Cyclosporin A. Blood Press. 1997;6:13-17.
47. Charnick SB, Nedelman JR, Chang CT, et al. Beschreibung von Blutdruckveränderungen bei Patienten, die eine Cyclosporin A-Therapie beginnen. Ther Drug Monit. 1997;19:17-24.
48. Cush JJ, Tugwell P, Weinblatt M, Yocum D. US consensus guidelines for use of cyclosporin A in rheumatoid arthritis. J Rheumatol. 1999;26:1176-1186.
49. Pham S, Kormos R, Hattler B, et al. A prospective trial of tacrolimus in clinical heart transplantation: intermediate-term results. J Thorac Cardiovasc Surg. 1996;111:764-772.
50. Fung JJ, Todo S, Jain A, et al. Conversion from cyclosporine to FK 506 in liver allograft recipients with cyclosporine-related complications. Transplant Proc. 1990;22:6-12.
51. Jain A, Reyes J, Kashyap R, et al. Lebertransplantation unter Tacrolimus bei Säuglingen, Kindern, Erwachsenen und Senioren: Langzeitergebnisse, Überleben und unerwünschte Ereignisse bei 1000 konsekutiven Patienten. Transplant Proc.1998;30:1403-1404.
Um diesen Artikel zu kommentieren, kontaktieren Sie [email protected].