Inleidende Scheikunde
Leerdoelen
Aan het einde van dit deel zul je in staat zijn om:
- De structuren van kleine moleculen kunnen voorspellen met behulp van de valentieschil-elektronenpaar-afstotingstheorie (VSEPR)
Tot nu toe hebben we tweedimensionale Lewis-structuren gebruikt om moleculen weer te geven. De moleculaire structuur is echter driedimensionaal en het is belangrijk dat we de moleculaire bindingen kunnen beschrijven in termen van afstanden, hoeken en relatieve rangschikkingen in de ruimte (figuur 1). Een bindingshoek is de hoek tussen twee bindingen die een gemeenschappelijk atoom bevatten, meestal gemeten in graden. Een bindingsafstand (of bindingslengte) is de afstand tussen de kernen van twee gebonden atomen langs de rechte lijn die de kernen verbindt. Bindingsafstanden worden gemeten in Ångstroms (1 Å = 10-10 m) of picometers (1 pm = 10-12 m, 100 pm = 1 Å).
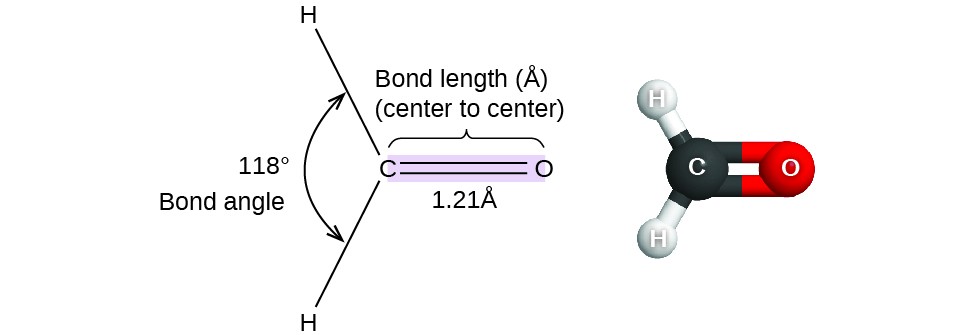
Figuur 1. Bindingsafstanden (lengtes) en -hoeken worden getoond voor het formaldehyde molecuul, H2CO.
VSEPR Theorie
Valence shell elektron-paar afstotingstheorie (VSEPR theorie) stelt ons in staat om de moleculaire structuur, inclusief benaderende bindingshoeken rond een centraal atoom, van een molecuul te voorspellen op basis van een onderzoek van het aantal bindingen en lone elektron paren in zijn Lewis structuur. Het VSEPR-model gaat ervan uit dat elektronenparen in de valentieschil van een centraal atoom een ordening aannemen die de afstotingen tussen deze elektronenparen minimaliseert door de afstand tussen hen te maximaliseren. De elektronen in de valentieschil van een centraal atoom vormen ofwel bindingsparen van elektronen, die zich hoofdzakelijk tussen bindingsatomen bevinden, ofwel alleenstaande paren. De elektrostatische afstoting van deze elektronen wordt verminderd wanneer de verschillende gebieden van hoge elektronendichtheid posities innemen die zo ver mogelijk van elkaar liggen.
VSEPR theorie voorspelt de opstelling van elektronenparen rond elk centraal atoom en, gewoonlijk, de juiste opstelling van atomen in een molecuul. We moeten echter begrijpen dat de theorie alleen rekening houdt met elektron-paar afstotingen. Andere interacties, zoals nucleair-nucleaire afstotingen en nucleair-elektron attracties, zijn ook betrokken bij de uiteindelijke rangschikking die atomen in een bepaalde moleculaire structuur aannemen.
Als een eenvoudig voorbeeld van de VSEPR-theorie, laten we de structuur van een gasvormig CO2-molecuul voorspellen. De Lewis-structuur van CO2 (figuur 2) toont slechts twee elektronenparen rond het centrale koolstofatoom. Met twee bindingen en geen eenzame elektronenparen op het centrale atoom liggen de bindingen zo ver mogelijk uit elkaar, en de elektrostatische afstoting tussen deze gebieden van hoge elektronendichtheid wordt tot een minimum beperkt wanneer ze zich aan weerszijden van het centrale atoom bevinden. De bindingshoek is 180° (figuur 2). Figuur 3 illustreert deze en andere elektronenpaargeometrieën die de afstoting tussen gebieden van hoge elektronendichtheid (bindingen en/of lone paren) minimaliseren. Twee gebieden van elektronendichtheid rond een centraal atoom in een molecuul vormen een lineaire geometrie; drie gebieden vormen een trigonale vlakke geometrie; vier gebieden vormen een tetrahedrale geometrie; vijf gebieden vormen een trigonale bipyramidale geometrie; en zes gebieden vormen een octahedrale geometrie.

Figuur 2. Koolstofdioxide heeft een lineaire structuur waarin de twee bindingen zo ver mogelijk uit elkaar liggen, aan weerszijden van het C-atoom

Figuur 3 De door de VSEPR-theorie voorspelde basisgeometrieën van elektronenparen maximaliseren de ruimte rond elk gebied met elektronendichtheid (bindingen of lone pairs).
Elektronenpaargeometrie versus moleculaire structuur
Het is belangrijk op te merken dat de elektronenpaargeometrie rond een centraal atoom niet hetzelfde is als de moleculaire structuur. De elektronenpaargeometrieën in figuur 3 beschrijven alle gebieden waar elektronen zich bevinden, zowel bindingen als alleenstaande paren. De moleculaire structuur beschrijft de plaats van de atomen, niet de elektronen.

Figuur 4. De moleculaire structuur van het methaanmolecuul CH4 is weergegeven met een tetrahedrale rangschikking van de waterstofatomen.
We maken onderscheid tussen deze twee situaties door de geometrie die alle elektronenparen omvat de elektronenpaargeometrie te noemen. De structuur die alleen de plaatsing van de atomen in het molecuul omvat, wordt de moleculaire structuur genoemd. De elektronenpaar-geometrieën zijn hetzelfde als de moleculaire structuren als er geen alleenstaande elektronenparen rond het centrale atoom zijn, maar ze zijn anders als er wel alleenstaande paren op het centrale atoom aanwezig zijn.
VSEPR-structuren zoals die in figuur 4 worden vaak getekend met de wiggen- en streepjesnotatie, waarbij vaste lijnen staan voor bindingen in het vlak van de pagina, vaste wiggen voor bindingen die uit het vlak omhoog komen, en streepjeslijnen voor bindingen die naar beneden in het vlak gaan. Zo heeft het methaanmolecuul CH4, het belangrijkste bestanddeel van aardgas, vier elektronenparen rond het centrale koolstofatoom; de geometrie van het elektronenpaar is tetrahedraal, net als de moleculaire structuur (figuur 4). Anderzijds heeft het ammoniakmolecuul, NH3, ook vier elektronenparen rond het stikstofatoom, en dus een tetrahedrale elektronenpaargeometrie. Eén van deze gebieden is echter een lone pair, dat niet in de moleculaire structuur is opgenomen, en dit lone pair beïnvloedt de vorm van het molecuul (figuur 5).

Figuur 5. (a) De elektronenpaargeometrie voor het ammoniakmolecuul is tetrahedral met één lone pair en drie enkele bindingen. (b) De trigonale piramidevormige molecuulstructuur wordt bepaald uit de elektronenpaargeometrie. (c) De werkelijke bindingshoeken wijken iets af van de geïdealiseerde hoeken, omdat het lone-pair een groter gebied inneemt dan de enkele bindingen, waardoor de HNH-hoek iets kleiner is dan 109,5°.
Zoals te zien in figuur 5, kunnen kleine vervormingen van de ideale hoeken in figuur 6 het gevolg zijn van verschillen in afstoting tussen verschillende gebieden van elektronendichtheid. De VSEPR-theorie voorspelt deze vervormingen door een volgorde van afstotingen vast te stellen en een volgorde van de hoeveelheid ruimte die door verschillende soorten elektronenparen wordt ingenomen. De volgorde van elektronenpaar-afstotingen van grootste naar minste afstoting is:
éénpaar-éénpaar >éénpaar-verbindend paar >verbindend paar-verbindend paar
Deze volgorde van afstotingen bepaalt de hoeveelheid ruimte die door verschillende elektronengebieden wordt ingenomen. Een eenzaam elektronenpaar neemt een groter ruimtegebied in dan de elektronen in een drievoudige binding; op zijn beurt nemen de elektronen in een drievoudige binding meer ruimte in dan die in een dubbele binding, enzovoort. De volgorde van grootte van grootste naar kleinste is:
eenpaar >drievoudige binding >dubbele binding>eenvoudige binding
Bedenk formaldehyde, H2CO, dat wordt gebruikt als conserveermiddel voor biologische en anatomische preparaten (figuur 1). Dit molecuul heeft gebieden met hoge elektronendichtheid die bestaan uit twee enkele bindingen en één dubbele binding. De basisgeometrie is trigonaal vlak met bindingshoeken van 120°, maar we zien dat de dubbele binding iets grotere hoeken veroorzaakt (121°), en dat de hoek tussen de enkele bindingen iets kleiner is (118°).
In het ammoniakmolecuul zijn de drie waterstofatomen die aan de centrale stikstof vastzitten niet gerangschikt in een vlakke, trigonaal vlakke moleculaire structuur, maar eerder in een driedimensionale trigonale piramide (figuur 5) met het stikstofatoom aan de top en de drie waterstofatomen die de basis vormen. De ideale bindingshoeken in een trigonale piramide zijn gebaseerd op de geometrie van de tetrahedrale elektronenparen. Ook hier zijn er kleine afwijkingen van het ideaal omdat eenzame paren grotere ruimtegebieden innemen dan bindingselektronen. De H-N-H-bindingshoeken in NH3 zijn iets kleiner dan de hoek van 109,5° in een regelmatig tetraëder (figuur 3) omdat de afstoting van het lone-paar-bindingspaar groter is dan de afstoting van het bindingspaar-bindingspaar (figuur 5). Figuur 6 illustreert de ideale molecuulstructuren, die zijn voorspeld op basis van de elektronenpaargeometrieën voor verschillende combinaties van lone paren en bindingsparen.

Figuur 6. De molecuulstructuren zijn identiek aan de elektronenpaargeometrieën wanneer er geen lone paren aanwezig zijn (eerste kolom).
Volgens de VSEPR-theorie zijn de eindpunten van de atomen (Xs in figuur 6) gelijkwaardig binnen de lineaire, trigonale en tetrahedrale elektronenpaargeometrieën (de eerste drie rijen van de tabel). Het maakt niet uit welke X wordt vervangen door een lone pair, omdat de moleculen kunnen worden geroteerd om posities om te zetten.
Voorspellen van elektronenpaargeometrie en moleculaire structuur
De volgende procedure maakt gebruik van de VSEPR-theorie om de elektronenpaargeometrieën en de moleculaire structuren te bepalen:
- Schrijf de Lewis-structuur van het molecuul of polyatomisch ion.
- Tel het aantal gebieden met elektronendichtheid (lone pairs en bindingen) rond het centrale atoom. Een enkele, dubbele of drievoudige binding telt als één gebied van elektronendichtheid.
- Identificeer de elektronenpaargeometrie op basis van het aantal gebieden van elektronendichtheid: lineair, trigonaal planair, of tetrahedraal. (figuur 6, eerste kolom).
- Gebruik het aantal lone pairs om de moleculaire structuur te bepalen (figuur 6). Als er meer dan één rangschikking van lone paren en chemische bindingen mogelijk is, kies dan de rangschikking die de afstotingen minimaliseert, en bedenk dat lone paren meer ruimte innemen dan meervoudige bindingen, die meer ruimte innemen dan enkelvoudige bindingen.
De volgende voorbeelden illustreren het gebruik van de VSEPR-theorie om de moleculaire structuur te voorspellen van moleculen of ionen die geen lone paren van elektronen hebben. In dit geval is de moleculaire structuur identiek aan de geometrie van de elektronenparen.
Voorbeeld 1: Voorspellen van elektronenpaargeometrie en moleculaire structuur
Voorspel de elektronenpaargeometrie en moleculaire structuur voor fosgeen, COCl2, een chemisch oorlogsmiddel dat tijdens de Eerste Wereldoorlog werd gebruikt
De volgende voorbeelden illustreren het effect van eenzame elektronenparen op de moleculaire structuur.
Voorbeeld 2: Voorspelling van elektronenpaargeometrie en moleculaire structuur: Lone Pairs on the Central Atom
Voorspel de elektronenpaargeometrie en de moleculaire structuur van een watermolecuul.
Voorbeeld 3: Moleculaire simulatie
Met de moleculaire vormsimulator kunnen we bepalen of bindingshoeken en/of eenzame paren worden weergegeven door de vakjes onder “Opties” aan de rechterkant aan of uit te vinken. We kunnen ook de “Naam” selectievakjes linksonder gebruiken om de geometrie van het elektronenpaar (in de simulator “elektronengeometrie” genoemd) en/of de molecuulstructuur (in de simulator “molecuulvorm” genoemd) te tonen of te verbergen.
Bouw het molecuul HCN in de simulator op basis van de volgende Lewis structuur:
ext{H-C}
Klik op elk bindingstype of lone pair aan de rechterkant om die groep aan het centrale atoom toe te voegen. Als je het complete molecuul hebt, draai het dan om de voorspelde moleculaire structuur te bekijken. Welke moleculaire structuur is dit?
Key Concepts and Summary
VSEPR-theorie voorspelt de driedimensionale rangschikking van atomen in een molecuul. Volgens deze theorie nemen valentie-elektronen een elektronenpaargeometrie aan die de afstoting tussen gebieden met een hoge elektronendichtheid (bindingen en/of eenzame paren) minimaliseert. Moleculaire structuur, die alleen betrekking heeft op de plaatsing van atomen in een molecuul en niet op de elektronen, is alleen gelijkwaardig aan elektronenpaargeometrie als er geen eenzame elektronenparen rond het centrale atoom zijn.
Oefeningen
- Leg het verschil uit tussen elektronenpaargeometrie en moleculaire structuur.
- Waarom is de H-N-H hoek in NH3 kleiner dan de H-C-H bindingshoek in CH4? Waarom is de H-N-H hoek in {text{NH}}_{4}^{+} identiek aan de H-C-H bindingshoek in CH4?
- Benoem de geometrie van het elektronenpaar en de moleculaire structuur van elk van de volgende moleculen:
- CF4
- PCl3
- SeF4
- ClNO (N is het centrale atoom)
- Cl2CO (C is het centrale atoom)
- Cl2SO (S is het centrale atoom)
- Cl2SeO (Se is het centrale atoom)
- F2SO (S is het centrale atoom)
- Een molecuul met de formule AB3, waarin A en B verschillende atomen voorstellen, zou een van drie verschillende vormen kunnen hebben. Schets en noem de drie verschillende vormen die dit molecuul zou kunnen hebben. Geef een voorbeeld van een molecuul of ion dat elke vorm heeft.
- Gebruik de PhET Molecuulvormsimulator om een molecuul te bouwen. Begin met het centrale atoom en klik op de dubbele binding om één dubbele binding toe te voegen. Voeg vervolgens een enkele binding en een lone pair toe. Roteer het molecuul om de volledige geometrie te bekijken. Geef de naam van de geometrie van de elektrongroep en de moleculaire structuur en voorspel de bindingshoek. Klik vervolgens op de selectievakjes onder en rechts van de simulator om je antwoorden te controleren.
- Gebruik de PhET Molecuulvormsimulator om echte moleculen te verkennen. Selecteer H2O op het tabblad Echte Moleculen. Schakel tussen de “echte” en “model” modi. Leg het waargenomen verschil uit.
- Gebruik de PhET Molecuulvormsimulator om echte moleculen te verkennen. Selecteer op het tabblad Echte moleculen de “model”-modus en S2O. Wat is de modelbindingshoek? Leg uit of de “echte” bindingshoek groter of kleiner moet zijn dan de ideale modelbindingshoek.
Benoem de geometrie van het elektronenpaar en de moleculaire structuur van elk van de volgende moleculen:
Een molecuul met de formule AB2, waarin A en B verschillende atomen voorstellen, kan een van de drie verschillende vormen hebben. Schets en noem de drie verschillende vormen die dit molecuul zou kunnen hebben. Geef bij elke vorm een voorbeeld van een molecuul of ion.
Glossary
bindingshoek: hoek tussen twee covalente bindingen die een gemeenschappelijk atoom delen
bindingsafstand: (ook, bindingslengte) afstand tussen de kernen van twee gebonden atomen
elektronenpaargeometrie: ordening rond een centraal atoom van alle gebieden van elektronendichtheid (bindingen, lone paren, of ongepaarde elektronen)
lineair: vorm waarin twee buitenste groepen aan tegenovergestelde zijden van een centraal atoom zijn geplaatst
moleculaire structuur: structuur die alleen de plaatsing van de atomen in het molecuul omvat
tetrahedraal: vorm waarbij vier buitengroepen rond een centraal atoom worden geplaatst, zodanig dat een driedimensionale vorm ontstaat met vier hoeken en 109.5° hoeken tussen elk paar en het centrale atoom
trigonaal vlak: vorm waarbij drie buitengroepen in een platte driehoek rond een centraal atoom worden geplaatst met hoeken van 120° tussen elk paar en het centrale atoom
valence shell elektron-paar afstotingstheorie (VSEPR): theorie die gebruikt wordt om de bindingshoeken in een molecuul te voorspellen op basis van het zo ver mogelijk uit elkaar plaatsen van gebieden met hoge elektronendichtheid om de elektrostatische afstoting te minimaliseren
vector: grootheid met magnitude en richting


