Wat is stoom?
Eigenschappen van stoom
Een beter begrip van de eigenschappen van stoom kan worden verkregen door de algemene moleculaire en atomaire structuur van materie te begrijpen, en deze kennis toe te passen op ijs, water en stoom.
Een molecuul is de kleinste hoeveelheid van een element of samengestelde stof die nog alle chemische eigenschappen van die stof kan bezitten en die kan bestaan. Moleculen zelf zijn opgebouwd uit nog kleinere deeltjes, atomen genaamd, die de basiselementen zoals waterstof en zuurstof definiëren.
De specifieke combinaties van deze atomaire elementen leveren samengestelde stoffen op. Eén zo’n verbinding wordt weergegeven door de chemische formule H2O, met moleculen die bestaan uit twee atomen waterstof en één atoom zuurstof.

De reden dat er zo veel water op aarde is, is dat waterstof en zuurstof tot de meest overvloedige elementen in het heelal behoren. Koolstof is een ander element met een grote overvloed, en is een belangrijk bestanddeel van alle organische materie.
De meeste minerale stoffen kunnen bestaan in de drie fysische toestanden (vast, vloeibaar en damp) die fasen worden genoemd. In het geval van H2O worden de termen ijs, water en stoom gebruikt om respectievelijk de drie fasen aan te duiden.
De moleculaire rangschikking van ijs, water en stoom wordt nog steeds niet volledig begrepen, maar het is handig om de moleculen te beschouwen als aan elkaar gebonden door elektrische ladingen (aangeduid als de waterstofbrug).
De mate van excitatie van de moleculen bepaalt de fysische toestand (of fase) van de stof.
Drievoudig punt
Alle drie fasen van een bepaalde stof kunnen slechts bij een bepaalde temperatuur en druk in evenwicht naast elkaar bestaan, en dit wordt het drievoudig punt genoemd.
Het drievoudig punt van H2O, waarbij de drie fasen ijs, water en stoom in evenwicht zijn, doet zich voor bij een temperatuur van 273,16 K en een absolute druk van 0,006 112 bar. Deze druk ligt zeer dicht bij een perfect vacuüm. Als de druk bij deze temperatuur verder wordt verlaagd, sublimeert het ijs, in plaats van te smelten, direct in stoom.
Ijs
In ijs zitten de moleculen opgesloten in een ordelijke roosterachtige structuur en kunnen ze alleen maar trillen. In de vaste fase is de beweging van de moleculen in het rooster een trilling rond een gemiddelde gebonden positie waarbij de moleculen minder dan één moleculaire diameter van elkaar verwijderd zijn.
De voortdurende toevoeging van warmte doet de trilling zodanig toenemen dat sommige moleculen uiteindelijk van hun buren zullen losraken, en de vaste stof begint te smelten tot een vloeibare toestand. Bij atmosferische druk vindt het smelten plaats bij 0°C. Veranderingen in druk hebben zeer weinig effect op de smelttemperatuur, en voor de meeste praktische doeleinden kan 0°C worden genomen als het smeltpunt. Er is echter aangetoond dat het smeltpunt van ijs met 0,0072°C daalt voor elke extra atmosfeer druk. Er zou bijvoorbeeld een druk van 13,9 bar g nodig zijn om de smelttemperatuur met 0,1°C te laten dalen.
Warmte die de roosterbindingen verbreekt om de faseverandering tot stand te brengen, terwijl de temperatuur van het ijs niet toeneemt, wordt enthalpie van smelt- of fusiewarmte genoemd. Dit verschijnsel van faseverandering is omkeerbaar wanneer bevriezing optreedt, waarbij dezelfde hoeveelheid warmte weer aan de omgeving wordt afgegeven.
Voor de meeste stoffen neemt de dichtheid af bij de overgang van de vaste naar de vloeibare fase. H2O is echter een uitzondering op deze regel: de dichtheid neemt toe bij het smelten, en daarom drijft ijs op water.
Water
In de vloeibare fase zijn de moleculen vrij om te bewegen, maar liggen nog steeds minder dan één moleculaire diameter uit elkaar als gevolg van wederzijdse aantrekkingskracht, en botsingen komen vaak voor. Meer warmte verhoogt de moleculaire agitatie en botsing, waardoor de temperatuur van de vloeistof stijgt tot zijn kooktemperatuur.
Enthalpie van water, vloeistofenthalpie of voelbare warmte (hf) van water
Dit is de warmte-energie die nodig is om de temperatuur van water te verhogen van een referentiepunt van 0°C tot zijn huidige temperatuur.
Bij deze referentietoestand van 0°C is de enthalpie van water willekeurig op nul gesteld. De enthalpie van alle andere toestanden kan dan worden vastgesteld ten opzichte van deze gemakkelijk toegankelijke referentietoestand.
Sensibele warmte was de term die vroeger werd gebruikt, omdat de aan het water toegevoegde warmte een verandering in temperatuur teweegbracht. Tegenwoordig wordt echter gesproken van enthalpie van water of enthalpie van water.
Bij atmosferische druk (0 bar g) kookt water bij 100°C, en er is 419 kJ energie nodig om 1 kg water te verwarmen van 0°C tot de kooktemperatuur van 100°C. Uit deze cijfers wordt de waarde voor de specifieke warmtecapaciteit van water (Cp) van 4,19 kJ/kg °C afgeleid voor de meeste berekeningen tussen 0°C en 100°C.
Stoom
Als de temperatuur stijgt en het water de kooktoestand nadert, bereiken sommige moleculen voldoende kinetische energie om snelheden te bereiken die hen in staat stellen tijdelijk uit de vloeistof te ontsnappen naar de ruimte boven het oppervlak, alvorens terug te vallen in de vloeistof.
Verdere verhitting veroorzaakt een grotere excitatie en het aantal moleculen met voldoende energie om de vloeistof te verlaten neemt toe. Als het water tot het kookpunt wordt verhit, vormen zich in het water stoombelletjes die opstijgen om door het oppervlak heen te breken.
Gezien de moleculaire rangschikking van vloeistoffen en dampen is het logisch dat de dichtheid van stoom veel lager is dan die van water, omdat de stoommoleculen verder van elkaar af staan. De ruimte direct boven het wateroppervlak wordt dus gevuld met minder dichte stoommoleculen.
Wanneer het aantal moleculen dat het vloeistofoppervlak verlaat groter is dan het aantal moleculen dat weer binnenkomt, verdampt het water vrijelijk. Op dit punt heeft het het kookpunt of de verzadigingstemperatuur bereikt, omdat het verzadigd is met warmte-energie.
Als de druk constant blijft, leidt het toevoegen van meer warmte er niet toe dat de temperatuur verder stijgt, maar dat het water verzadigde stoom vormt. De temperatuur van het kokende water en van de verzadigde stoom in hetzelfde systeem is gelijk, maar de warmte-energie per massa-eenheid is veel groter in de stoom.
Bij atmosferische druk is de verzadigingstemperatuur 100°C. Als de druk echter wordt verhoogd, kan meer warmte worden toegevoegd en kan de temperatuur worden verhoogd zonder dat de fase verandert.
Daarom verhoogt verhoging van de druk zowel de enthalpie van water als de verzadigingstemperatuur. Het verband tussen de verzadigingstemperatuur en de druk staat bekend als de stoomverzadigingskromme (zie onderstaande afbeelding).
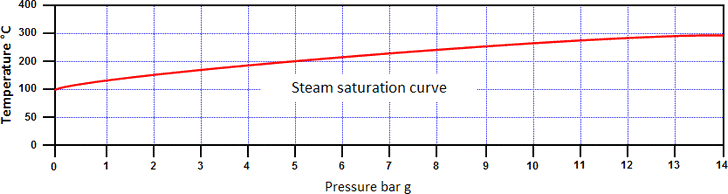
Water en stoom kunnen bij elke druk op deze kromme naast elkaar bestaan, omdat beide zich op de verzadigingstemperatuur bevinden. Stoom in een toestand boven de verzadigingskromme wordt oververhitte stoom genoemd:
- De temperatuur boven de verzadigingstemperatuur wordt de mate van oververhitting van de stoom genoemd.
- Water in een toestand onder de kromme wordt onderverzadigd water genoemd.
Als de stoom met dezelfde snelheid uit de ketel kan stromen als hij wordt geproduceerd, verhoogt de toevoeging van extra warmte eenvoudig de productiesnelheid. Als de stoom de ketel niet kan verlaten en de warmte-inbreng gehandhaafd blijft, zal de energie die in de ketel stroomt groter zijn dan de energie die eruit stroomt. Deze overtollige energie verhoogt de druk, waardoor de verzadigingstemperatuur kan stijgen, aangezien de temperatuur van verzadigde stoom samenhangt met de druk.
Enthalpie van verdamping of latente warmte (hfg)
Dit is de hoeveelheid warmte die nodig is om de toestand van water op kooktemperatuur te veranderen in stoom. Er is geen verandering in de temperatuur van het mengsel van stoom en water, en alle energie wordt gebruikt om de toestand van vloeistof (water) in damp (verzadigde stoom) te veranderen.
De oude term latente warmte is gebaseerd op het feit dat er weliswaar warmte werd toegevoegd, maar dat er geen verandering in temperatuur plaatsvond. De gangbare term is nu echter enthalpie van verdamping.
Net als de faseverandering van ijs naar water is ook het verdampingsproces omkeerbaar. Dezelfde hoeveelheid warmte die de stoom heeft geproduceerd, wordt tijdens de condensatie, wanneer de stoom een oppervlak met een lagere temperatuur ontmoet, weer aan de omgeving afgegeven.
Dit kan worden beschouwd als het nuttige deel van de warmte in de stoom voor verwarmingsdoeleinden, omdat het dat deel van de totale warmte in de stoom is dat wordt onttrokken wanneer de stoom weer condenseert tot water.
Enthalpie van verzadigde stoom, of totale warmte van verzadigde stoom
Dit is de totale energie in verzadigde stoom, en is eenvoudig de som van de enthalpie van water en de enthalpie van verdamping.
hg = hf + hfg
- hg = Totale enthalpie van verzadigde stoom (Totale warmte) (kJ/kg)
- hf = Vloeistofenthalpie (Voelbare warmte) (kJ/kg)
- hfg = Enthalpie van verdamping (latente warmte) (kJ/kg)
Verzadigde stoomtabel
Een stoomtabel geeft een overzicht van de eigenschappen van stoom bij variërende druk. Zij zijn de resultaten van werkelijke proeven die met stoom zijn uitgevoerd. De tabel hieronder toont de eigenschappen van droge verzadigde stoom bij atmosferische druk – 0 barg tot 5 barg.
| Druk barg |
Sat- uration temp °C |
Enthalpie (energie) in kJ/kg | Volume van droge verzadigde stoom m3/kg |
Water hf | Eva- poration hfg |
Steam hg |
| 100 | 419 | 2257 | 2676 | 1.673 | |
| 1 | 120 | 506 | 2201 | 2707 | 0.881 |
| 2 | 134 | 562 | 2163 | 2725 | 0.603 |
| 3 | 144 | 605 | 2133 | 2738 | 0.461 |
| 4 | 152 | 641 | 2108 | 2749 | 0.461 |
| 4 | 2163 | 0.461 | |||
| 0.374 | |||||
| 5 | 159 | 671 | 2086 | 2757 | 0.315 |
Droogheidsfracties
Stoom met een temperatuur gelijk aan het kookpunt bij die druk staat bekend als droge verzadigde stoom. Het is echter zelden mogelijk om 100% droge stoom te produceren in een industriële ketel die is ontworpen om verzadigde stoom te produceren, en de stoom zal meestal waterdruppeltjes bevatten.
In de praktijk bevat de stoomruimte, als gevolg van turbulentie en spatten, wanneer stoombelletjes door het wateroppervlak breken, een mengsel van waterdruppeltjes en stoom.
Stoom geproduceerd in een shell-type ketel, waar de warmte alleen aan het water wordt geleverd en waar de stoom in contact blijft met het wateroppervlak, kan typisch ongeveer 5% water bevatten in massa.
Als de waterinhoud van de stoom 5‰ massaprocent is, dan is de stoom 95% droog en heeft hij een droogtefractie van 0,95.
De werkelijke enthalpie van de verdamping van natte stoom is het product van de droogtefractie (X) en de specifieke enthalpie (hfg) uit de stoomtabellen. Natte stoom zal een lagere bruikbare warmte-energie hebben dan droge verzadigde stoom.
Actuele enthalpie van verdamping = hfgX
Daarom:
Actuele totale enthalpie = hf + hfgX
Omdat het soortelijk volume van water enkele orden van grootte lager is dan dat van stoom, zullen de waterdruppeltjes in natte stoom een verwaarloosbare ruimte innemen. Daarom zal het specifieke volume van natte stoom kleiner zijn dan dat van droge stoom:
Het werkelijke specifieke volume = VgX
Waarbij Vg het specifieke volume van droge verzadigde stoom is.
Het stoomfasendiagram
De gegevens uit de stoomtabellen kunnen ook grafisch worden weergegeven. De onderstaande afbeelding illustreert het verband tussen de enthalpie en de temperatuur van de verschillende toestanden van water en stoom; dit wordt een fasediagram genoemd.
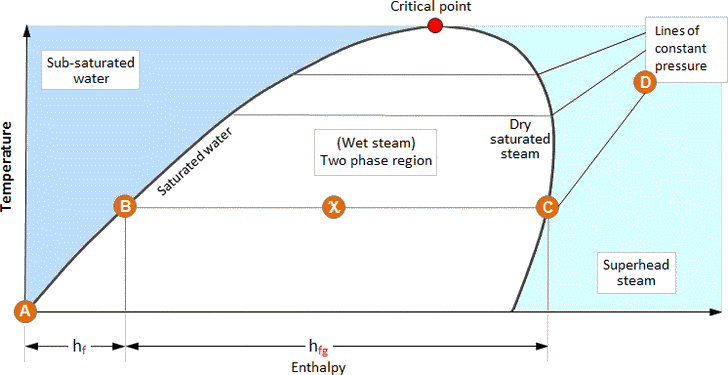
Als water wordt verwarmd van 0°C tot zijn verzadigingstemperatuur, volgt zijn toestand de verzadigd-waterlijn totdat het al zijn vloeibare enthalpie, hf (A – B), heeft ontvangen.
Als er nog meer warmte wordt toegevoegd, verandert het water van fase en gaat het over in een water/dampmengsel en blijft het in enthalpie toenemen terwijl het op verzadigingstemperatuur blijft, hfg (B – C).
Als het water/dampmengsel droger wordt, gaat de toestand ervan over van de verzadigde vloeistoflijn naar de verzadigde damplijn. Op een punt precies halverwege tussen deze twee toestanden is de droogtefractie (X) dus 0,5. Op dezelfde manier is de stoom op de verzadigde stoomlijn 100% droog.
Als de stoom al zijn enthalpie van verdamping heeft ontvangen, bereikt hij de verzadigde stoomlijn. Als hij daarna nog verder wordt verwarmd, blijft de druk constant, maar de temperatuur van de stoom begint te stijgen door oververhitting (C – D).
De lijnen voor verzadigd water en verzadigde stoom omsluiten een gebied waarin een water/dampmengsel bestaat – natte stoom. In het gebied links van de verzadigde waterlijn bestaat alleen water, en in het gebied rechts van de verzadigde stoomlijn bestaat alleen oververhitte stoom.
Het punt waar de verzadigde waterlijn en de verzadigde stoomlijn elkaar raken staat bekend als het kritieke punt. Naarmate de druk toeneemt in de richting van het kritieke punt, neemt de enthalpie van de verdamping af, totdat deze bij het kritieke punt nul wordt. Dit wijst erop dat water bij het kritieke punt rechtstreeks overgaat in verzadigde stoom.
Boven het kritieke punt kan de stoom worden beschouwd als een gas. De gasvormige toestand is de meest diffuse toestand waarin de moleculen een vrijwel onbeperkte beweging hebben, en het volume onbeperkt toeneemt naarmate de druk afneemt.
Het kritieke punt is de hoogste temperatuur waarbij water kan bestaan. Elke compressie bij constante temperatuur boven het kritieke punt zal geen faseverandering teweegbrengen.
Compressie bij constante temperatuur onder het kritieke punt zal echter resulteren in het vloeibaar worden van de damp wanneer deze van het oververhitte gebied overgaat in het natte stoomgebied.
Het kritieke punt doet zich voor bij 374,15°C en 221,2 bar a voor stoom. Boven deze druk wordt de stoom superkritisch genoemd en geldt er geen welomschreven kookpunt.
Vlampstoom
De term “vlampstoom” wordt traditioneel gebruikt om stoom aan te duiden die vrijkomt uit condensaatopvangopeningen en condensaatafvoerleidingen met open uiteinden van condenspotten. Hoe kan stoom uit water worden gevormd zonder warmte toe te voegen?
Vlamdamp ontstaat wanneer water onder hoge druk (en met een temperatuur hoger dan de verzadigingstemperatuur van de lagedrukvloeistof) tot een lagere druk wordt toegelaten. Omgekeerd, als de temperatuur van het water onder hoge druk lager is dan de verzadigingstemperatuur bij de lagere druk, kan geen flashstoom worden gevormd. In het geval van condensaat dat door een condenspot gaat, is het gewoonlijk zo dat de temperatuur stroomopwaarts hoog genoeg is om flashstoom te vormen. Zie de afbeelding hieronder
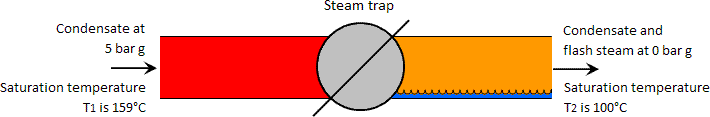
Zie een kilogram condensaat bij 5 bar g en een verzadigingstemperatuur van 159°C die door een condenspot gaat naar een lagere druk van 0 bar g. De hoeveelheid energie in een kilogram condensaat bij verzadigingstemperatuur bij 5 bar g is 671 kJ. Volgens de eerste wet van de thermodynamica moet de hoeveelheid energie in de vloeistof aan de lagedrukzijde van de condenspot gelijk zijn aan die aan de hogedrukzijde, en geldt het principe van behoud van energie.
Dientengevolge is de hoeveelheid warmte in een kilogram lagedrukvloeistof ook 671 kJ. Water bij 0 bar g kan echter slechts 419 kJ warmte bevatten, zodat er aan de lagedrukzijde een onbalans van warmte blijkt te zijn van 671 – 419 = 252 kJ, die, wat het water betreft, als overtollige warmte kan worden beschouwd.
Door deze overtollige warmte kookt een deel van het condensaat tot wat bekend staat als flashstoom en het kookproces wordt flashing genoemd. Het condensaat van één kilogram dat aan de hogedrukzijde van de condenspot als één kilogram vloeibaar water bestond, bestaat nu dus gedeeltelijk als water en stoom aan de lagedrukzijde.
De hoeveelheid geproduceerde flashstoom bij de einddruk (P2) kan worden bepaald met:
Verhouding flashstoom = (hf bij P1) – (hf bij P2) / hfg bij P2
- P1 = Begindruk
- P2 = Einddruk
- hf = Vloeistofenthalpie (kJ/kg)
- hfg = Enthalpie van verdamping (kJ/kg)
Voorbeeld: Het geval waarin de hogedrukcondensaattemperatuur hoger is dan de lagedrukverzadigingstemperatuur.
Beschouw een hoeveelheid water bij een druk van 5 bar g, die 671 kJ/kg warmte-energie bevat bij zijn verzadigingstemperatuur van 159°C. Als de druk vervolgens werd verlaagd tot de atmosferische druk (0 bar g), zou het water slechts bij 100°C kunnen bestaan en 419 kJ/kg warmte-energie bevatten. Dit verschil van 671 – 419 = 252 kJ/kg warmte-energie, zou dan bij atmosferische druk flashstoom opleveren.
670,9 – 419,0
2257,0
670,9 – 419,0
2257,0
670.9 – 419.0
0.11 kg stoom / kg water
Het aandeel geproduceerde flashstoom kan worden opgevat als de verhouding tussen de overtollige energie en de enthalpie van de verdamping bij de einddruk.
Voorbeeld: Het geval waarin de hogedrukcondensaattemperatuur lager is dan de lagedrukverzadigingstemperatuur.
De temperatuur ligt bij 90°C, dat wil zeggen, ondergekoeld onder de atmosferische verzadigingstemperatuur van 100°C. Opmerking: Het is gewoonlijk niet praktisch voor een dergelijke grote daling in condensaattemperatuur van zijn verzadigingstemperatuur (in dit geval 159°C tot 90°C); het wordt alleen gebruikt om het punt te illustreren over flashstoom die onder dergelijke omstandigheden niet wordt geproduceerd.
In dit geval zal de tabel van het onderverzadigde water aantonen dat de vloeibare enthalpie van één kilogram condensaat bij 5 barg en 90°C 377 kJ is. Aangezien deze enthalpie lager is dan de enthalpie van een kilogram verzadigd water bij atmosferische druk (419 kJ), is er geen overtollige warmte beschikbaar om flashstoom te produceren. Het condensaat gaat gewoon door de condenspot en blijft in vloeibare toestand bij dezelfde temperatuur maar lagere druk, atmosferische druk in dit geval. Zie de afbeelding hieronder.
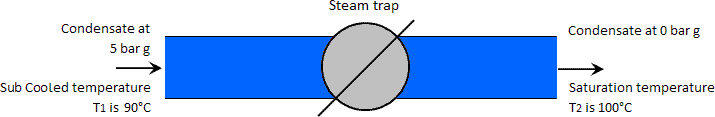
De dampdruk van water bij 90°C is 0,7 bar absoluut. Zou de lagere condensaatdruk lager zijn geweest, dan zou er flashstoom zijn geproduceerd.
De principes van behoud van energie en massa tussen twee procestoestanden.
De principes van behoud van energie en massa maken het mogelijk het fenomeen flashstoom vanuit een andere richting te bezien.
1 kg condensaat bij 5 bar g en 159°C produceert 0,112 kg flashstoom bij atmosferische druk. Dit kan schematisch worden weergegeven in de onderstaande tabel. De totale massa van flash en condensaat blijft 1 kg.
1 kg condensaat
159°C
Enthalpie 671 kJ
0.112 flashstoom
0,888 condensaat
Het principe van behoud van energie stelt dat de totale energie in de lagedruktoestand gelijk moet zijn aan de totale energie in de hogedruktoestand. Daarom moet de hoeveelheid warmte in de flashstoom en het condensaat gelijk zijn aan die in het oorspronkelijke condensaat van 671 kJ.
Stoomtabellen geven de volgende informatie:
- Totale enthalpie van verzadigd water bij atmosferische druk (hf) = 419 kJ/kg
- Totale enthalpie in verzadigde stoom bij atmosferische druk (hg) = 2 675 kJ/kg
- Daaruit volgt bij de lagere druktoestand van 0 bar g
- Totale enthalpie in het water = 0.888 kg x 419 kJ / kg = 372 kJ (A)
- Totale enthalpie in de stoom = 0.112 kg x 2 675 kJ / kg = 299 kJ (B)
- Totale enthalpie in condensaat en stoom bij de lagere druk = A + B = 671 kJ
Dus, de stoomtabellen, de enthalpie verwacht in de lagere-druktoestand is dezelfde als die in de hogere-druktoestand, dus het bewijs van het principe van behoud van energie.
Algemeen
Verzadigde stoom
Stoom is waterdamp. Bij een gegeven temperatuur is er een bepaalde dampdruk die in evenwicht is met vloeibaar water. Dat is “natte” of verzadigde stoom. Als de temperatuur van de stoom hoger is dan de temperatuur waarbij deze in evenwicht is met een bepaalde druk van waterdamp, wordt de damp oververhit (verwarmd tot boven de temperatuur die overeenkomt met de dampdruk in evenwicht) en wordt de stoom “droog” genoemd.Er is een verband tussen druk en temperatuur, als men de temperatuur kent, kan men de druk bepalen. Als de druk bekend is, is ook de temperatuur bekend.
Superverhitte stoom
Als verzadigde stoom verder wordt verhit, zal het vocht afnemen. De resterende waterdruppels worden kleiner en gaan over in de dampfase. Bij temperaturen van 10-20°C boven de temperatuur van verzadigde stoom is oververhitting opgetreden.
Gevolge de slechte warmteoverdracht is oververhitte stoom beter voor warmtetransport (stoomdoorstroming in lange pijpleidingen).
Gevolge de goede warmteoverdracht is verzadigde stoom beter voor warmteoverdracht (verwarming van warmtewisselaars moet verzadigde stoom worden gebruikt).
Vlamdamp
Vlamdamp komt vrij uit heet condensaat als de druk ervan wordt verlaagd. Zelfs water bij een kamertemperatuur van 20°C zou koken als de druk ver genoeg werd verlaagd. Het is de moeite waard op te merken dat water van 170°C zal koken bij elke druk lager dan 6,9 bar g. De stoom die vrijkomt bij het flashproces is even bruikbaar als stoom die vrijkomt uit een stoomketel.
Als voorbeeld: wanneer stoom uit een ketel wordt gehaald en de druk in de ketel daalt, zal een deel van de waterinhoud van de ketel flashen om de “levende” stoom aan te vullen die wordt geproduceerd door de warmte van de ketelbrandstof. Omdat beide soorten stoom in de ketel worden geproduceerd, is het onmogelijk ze van elkaar te onderscheiden. Alleen wanneer flash plaatsvindt bij relatief lage druk, zoals aan de uitlaatzijde van condenspotten, wordt de term flash-stoom veel gebruikt. Helaas heeft dit gebruik geleid tot de onjuiste conclusie dat flashstoom op de een of andere manier minder waardevol is dan zogenaamde levende stoom.
In elk stoomsysteem dat een zo hoog mogelijk rendement nastreeft, zal flashstoom worden gescheiden van het condensaat, en worden gebruikt als aanvulling op elke lagedrukverwarmingstoepassing. Elke kilogram flashstoom die op deze manier wordt gebruikt, is een kilogram stoom die niet door de ketel hoeft te worden geleverd. Het is ook een kilogram stoom die niet wordt afgevoerd naar de atmosfeer, waar hij anders verloren zou gaan.
De redenen voor het terugwinnen van flashstoom zijn even overtuigend, zowel economisch als ecologisch, als de redenen voor het terugwinnen van condensaat.
Noot:
De toestand van stoom wordt bepaald door drie variabelen:
- Dampdruk
- Temperatuur van de stoom
- Volume van de stoom, dat afhankelijk is van de druk en de temperatuur
De dampdruk en de temperatuur kunnen relatief eenvoudig worden gemeten. Het volume van de stoom kan op een vergelijkbare referentie worden bekeken.
Stijgende energiekosten
In tijden van stijgende energiekosten is het voor de exploitant van een energie-intensief stoom- en condensaatsysteem van belang om de soms behoorlijk verfijnde thermodynamische processen te begrijpen. Hetzelfde stoom- en condensaatsysteem, dat een paar jaar geleden nog tamelijk triviaal werd behandeld, staat nu als gevolg van de hogere energieprijzen plotseling in het middelpunt van de belangstelling.
De beste manier om problemen op te sporen, heeft de exploitant. Hij is elke dag op de faciliteit en moet bekend zijn met elke klep en elke pomp. De vaardigheden zijn vaak voldoende om het energieverbruik van een installatie te controleren en de technische zin te optimaliseren.
Energiebesparende maatregelen kunnen al in kleine maatregelen worden uitgevoerd. De eerste energiebesparende maatregel is dat de exploitant zijn systeem moet herzien om te bepalen of de pompen, regelkleppen, warmtewisselaars, enz. werkelijk overeenkomen met de omstandigheden waarvoor zij oorspronkelijk zijn ontworpen. Dit vereist dat de exploitant zijn systeem kent en de basisrelaties begrijpt.