O que é Vapor?
Propriedades do Vapor
Uma melhor compreensão das propriedades do vapor pode ser alcançada através da compreensão da estrutura molecular e atómica geral da matéria, e da aplicação deste conhecimento ao gelo, à água e ao vapor.
Uma molécula é a menor quantidade de qualquer elemento ou substância composta que ainda possua todas as propriedades químicas dessa substância que possam existir. As próprias moléculas são constituídas por partículas ainda mais pequenas chamadas átomos, que definem os elementos básicos tais como hidrogénio e oxigénio.
As combinações específicas destes elementos atómicos fornecem substâncias compostas. Um desses compostos é representado pela fórmula química H2O, tendo moléculas constituídas por dois átomos de hidrogénio e um átomo de oxigénio.

A razão pela qual a água é tão abundante na terra é porque o hidrogénio e o oxigénio estão entre os elementos mais abundantes do universo. O carbono é outro elemento de abundância significativa, e é um componente chave em toda a matéria orgânica.
As substâncias mais minerais podem existir nos três estados físicos (sólido, líquido e vapor) que são referidos como fases. No caso do H2O, os termos gelo, água e vapor são utilizados para designar as três fases respectivamente.
A disposição molecular do gelo, água e vapor ainda não é totalmente compreendida, mas é conveniente considerar as moléculas como ligadas entre si por cargas eléctricas (referidas como a ligação de hidrogénio).
O grau de excitação das moléculas determina o estado físico (ou fase) da substância.
Triplo ponto
Todas as três fases de uma determinada substância só podem coexistir em equilíbrio a uma certa temperatura e pressão, e isto é conhecido como o seu ponto triplo.
O ponto triplo de H2O, onde as três fases de gelo, água e vapor estão em equilíbrio, ocorre a uma temperatura de 273,16 K e a uma pressão absoluta de 0,006 112 bar. Esta pressão está muito próxima de um vácuo perfeito. Se a pressão for reduzida ainda mais a esta temperatura, o gelo, em vez de derreter, sublima-se directamente em vapor.
Ice
No gelo, as moléculas são trancadas juntas numa estrutura do tipo grelha ordenada e só podem vibrar. Na fase sólida, o movimento das moléculas na grelha é uma vibração sobre uma posição de ligação média onde as moléculas estão separadas por menos de um diâmetro molecular.
A adição contínua de calor faz com que a vibração aumente a tal ponto que algumas moléculas acabam por se separar dos seus vizinhos, e o sólido começa a derreter para um estado líquido. À pressão atmosférica, o derretimento ocorre a 0°C. Alterações na pressão têm muito pouco efeito sobre a temperatura de fusão, e para a maioria dos fins práticos, 0°C pode ser tomado como ponto de fusão. Por exemplo, uma pressão de 13,9 bar g seria necessária para reduzir a temperatura de fusão em 0,1°C.
C>Calor que quebra as ligações da malha para produzir a mudança de fase sem aumentar a temperatura do gelo, é referido como entalpia de fusão ou calor de fusão. Este fenómeno de mudança de fase é reversível quando o congelamento ocorre com a mesma quantidade de calor a ser libertada de volta para o ambiente.
Para a maioria das substâncias, a densidade diminui à medida que muda da fase sólida para a fase líquida. Contudo, o H2O é uma excepção a esta regra à medida que a sua densidade aumenta ao derreter, razão pela qual o gelo flutua na água.
Água
Na fase líquida, as moléculas são livres de se moverem, mas ainda estão separadas por menos de um diâmetro molecular devido à atracção mútua, e as colisões ocorrem frequentemente. Mais calor aumenta a agitação molecular e a colisão, elevando a temperatura do líquido até à sua temperatura de ebulição.
Entalpia da água, entalpia líquida ou calor sensível (hf) da água
Esta é a energia térmica necessária para elevar a temperatura da água de um ponto de referência de 0°C à sua temperatura actual.
Neste estado de referência de 0°C, a entalpia da água foi arbitrariamente fixada em zero. A entalpia de todos os outros estados pode então ser identificada, relativamente a este estado de referência facilmente acessível.
Calor sensível foi o termo uma vez utilizado, porque o calor adicionado à água produziu uma alteração da temperatura. Contudo, os termos aceites actualmente são entalpia líquida ou entalpia da água.
A pressão atmosférica (0 bar g), a água ferve a 100°C, e são necessários 419 kJ de energia para aquecer 1 kg de água desde 0°C até à sua temperatura de ebulição de 100°C. É a partir destes valores que o valor da capacidade térmica específica da água (Cp) de 4,19 kJ/kg °C é derivado para a maioria dos cálculos entre 0°C e 100°C.
Vapor
À medida que a temperatura aumenta e a água se aproxima da sua condição de ebulição, algumas moléculas atingem energia cinética suficiente para atingir velocidades que lhes permitem escapar momentaneamente do líquido para o espaço acima da superfície, antes de cair de novo no líquido.
Outro aquecimento provoca maior excitação e o número de moléculas com energia suficiente para deixar o líquido aumenta. Como a água é aquecida até ao seu ponto de ebulição, bolhas de vapor formam-se dentro dela e sobem para quebrar a superfície.
Considerando a disposição molecular de líquidos e vapores, é lógico que a densidade do vapor é muito inferior à da água, porque as moléculas de vapor estão mais afastadas umas das outras. O espaço imediatamente acima da superfície da água torna-se assim preenchido por moléculas de vapor menos densas.
Quando o número de moléculas que saem da superfície do líquido é superior ao das que reentram, a água evapora livremente. Neste ponto atingiu o ponto de ebulição ou a sua temperatura de saturação, pois está saturada com energia térmica.
Se a pressão se mantiver constante, a adição de mais calor não faz com que a temperatura suba mais, mas faz com que a água forme vapor saturado. A temperatura da água a ferver e do vapor saturado dentro do mesmo sistema é a mesma, mas a energia térmica por unidade de massa é muito maior no vapor.
À pressão atmosférica, a temperatura de saturação é de 100°C. No entanto, se a pressão for aumentada, isto permitirá a adição de mais calor e um aumento da temperatura sem uma mudança de fase.
Por isso, o aumento da pressão aumenta efectivamente tanto a entalpia da água, como a temperatura de saturação. A relação entre a temperatura de saturação e a pressão é conhecida como curva de saturação de vapor (ver imagem abaixo).
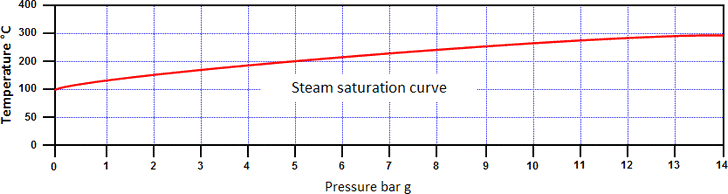
A água e o vapor podem coexistir a qualquer pressão nesta curva, estando ambos à temperatura de saturação. O vapor numa condição acima da curva de saturação é conhecido como vapor sobreaquecido:
- Temperatura acima da temperatura de saturação é chamada o grau de sobreaquecimento do vapor.
- Água numa condição abaixo da curva é chamada água sub-saturada.
Se o vapor for capaz de fluir da caldeira à mesma velocidade em que é produzido, a adição de mais calor simplesmente aumenta a taxa de produção. Se o vapor for impedido de sair da caldeira, e a taxa de entrada de calor for mantida, a energia que flui para a caldeira será maior do que a energia que flui para fora. Este excesso de energia aumenta a pressão, permitindo por sua vez que a temperatura de saturação aumente, à medida que a temperatura do vapor saturado se correlaciona com a sua pressão.
p>Entalpia de evaporação ou calor latente (hfg)
Esta é a quantidade de calor necessária para alterar o estado da água à sua temperatura de ebulição, para vapor. Não envolve nenhuma alteração na temperatura da mistura vapor/água, e toda a energia é utilizada para alterar o estado de líquido (água) para vapor (vapor saturado).
O antigo termo calor latente baseia-se no facto de que, embora se tenha adicionado calor, não houve alteração na temperatura. No entanto, o termo aceite é agora entalpia da evaporação.
Como a mudança de fase do gelo para a água, o processo de evaporação é também reversível. A mesma quantidade de calor que produziu o vapor é libertada de volta ao seu ambiente durante a condensação, quando o vapor encontra qualquer superfície a uma temperatura mais baixa.
Esta pode ser considerada como a porção útil de calor no vapor para fins de aquecimento, pois é a porção do calor total no vapor que é extraído quando o vapor condensa de volta à água.
Entalpia do vapor saturado, ou calor total do vapor saturado
Esta é a energia total no vapor saturado, e é simplesmente a soma da entalpia da água e da entalpia da evaporação.
hg = hf + hfg
- hg = Entalpia total do vapor saturado (Calor total) (kJ/kg)
- hf = Entalpia líquida (Calor sensível) (kJ/kg)
- hfg = Enthalpy de evaporação (calor latente) (kJ/kg)
Tabela de vapor saturado
Uma tabela de vapor lista as propriedades do vapor a pressões variáveis. São os resultados de testes reais realizados sobre o vapor. A tabela abaixo mostra as propriedades do vapor saturado seco à pressão atmosférica – 0 barg até 5 barg.
| Prensa barg |
Sat- dura temp °C |
Enthalpy (energia) em kJ/kg | Volume de vapor seco vapor saturado m3/kg |
||
| Água hf | Eva- poração hfg |
Steam hg | |||
| 0 | 100 | 419 | 2257 | 2676 | 1.673 |
| 1 | 120 | 506 | 2201 | 2707 | 0.881 |
| 2 | 134 | 562 | 2163 | 2725 | 0.603 |
| 3 | 144 | 605 | 2133 | 2738 | 0,461 | 4 | 152 | 641 | 2108 | 2749 | 0.374 |
| 5 | 159 | 671 | 2086 | 2757 | 0.315 |
Fracções de secura
Vapor com uma temperatura igual ao ponto de ebulição a essa pressão é conhecido como vapor saturado seco. No entanto, para produzir vapor 100% seco numa caldeira industrial concebida para produzir vapor saturado raramente é possível, e o vapor conterá normalmente gotículas de água.
Na prática, devido à turbulência e salpicos, à medida que bolhas de vapor rompem a superfície da água, o espaço de vapor contém uma mistura de gotículas de água e vapor.
Vapor produzido em qualquer caldeira tipo concha, onde o calor é fornecido apenas à água e onde o vapor permanece em contacto com a superfície da água, pode normalmente conter cerca de 5% de água por massa.
Se o conteúdo de água do vapor for 5‰ em massa, então diz-se que o vapor está 95% seco e tem uma fracção de secura de 0,95.
A entalpia real de evaporação do vapor húmido é o produto da fracção de secura (X) e da entalpia específica (hfg) das tabelas de vapor. O vapor húmido terá uma energia térmica utilizável inferior à do vapor saturado seco.
Entalpia real de evaporação = hfgX
Therfore:
Entalpia total real = hf + hfgX
Porque o volume específico de água é várias ordens de magnitude inferior ao do vapor, as gotículas de água no vapor húmido ocuparão um espaço insignificante. Portanto, o volume específico de vapor húmido será inferior ao do vapor seco:
Vapor específico real = VgX
onde Vg é o volume específico de vapor saturado seco.
O diagrama de fase de vapor
Os dados fornecidos nas tabelas de vapor também podem ser expressos de forma gráfica. A imagem abaixo ilustra a relação entre a entalpia e a temperatura dos vários estados de água e vapor; isto é conhecido como diagrama de fase.
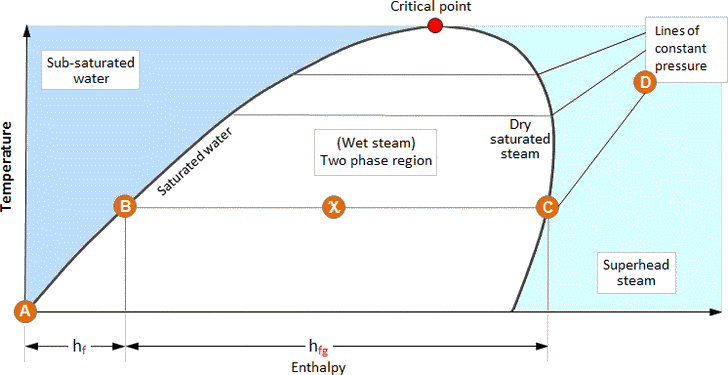
As águas são aquecidas desde 0°C até à sua temperatura de saturação, o seu estado segue a linha de água saturada até ter recebido toda a sua entalpia líquida, hf (A – B).
Se continuar a ser adicionado mais calor, a água muda de fase para uma mistura água/vapor e continua a aumentar em entalpia enquanto permanece à temperatura de saturação, hfg (B – C).
Asso que a mistura água/vapor aumenta em secura, o seu estado passa da linha de líquido saturado para a linha de vapor saturado. Portanto, num ponto exactamente a meio caminho entre estes dois estados, a fracção de secura (X) é de 0,5. Da mesma forma, na linha de vapor saturado o vapor é 100% seco.
Após ter recebido toda a sua entalpia de evaporação, alcança a linha de vapor saturado. Se continuar a ser aquecido após este ponto, a pressão permanece constante mas a temperatura do vapor começará a subir à medida que o sobreaquecimento é transmitido (C – D).
As linhas de água saturada e vapor saturado envolvem uma região na qual existe uma mistura de água/vapor – vapor húmido. Na região à esquerda da linha de água saturada só existe água, e na região à direita da linha de vapor saturado só existe vapor sobreaquecido.
O ponto em que as linhas de água saturada e vapor saturado se encontram é conhecido como o ponto crítico. À medida que a pressão aumenta para o ponto crítico, a entalpia da evaporação diminui, até se tornar zero no ponto crítico. Isto sugere que a água se transforma directamente em vapor saturado no ponto crítico.
Acima do ponto crítico o vapor pode ser considerado como um gás. O estado gasoso é o estado mais difuso em que as moléculas têm um movimento quase sem restrições, e o volume aumenta sem limites à medida que a pressão é reduzida.
O ponto crítico é a temperatura mais alta a que a água pode existir. Qualquer compressão a temperatura constante acima do ponto crítico não produzirá uma mudança de fase.
Compressão a temperatura constante abaixo do ponto crítico, contudo, resultará na liquefacção do vapor à medida que este passa da região sobreaquecida para a região húmida do vapor.
O ponto crítico ocorre a 374,15°C e 221,2 bar a para o vapor. Acima desta pressão o vapor é denominado supercrítico e não se aplica nenhum ponto de ebulição bem definido.
Flash steam
O termo “vapor flash” é tradicionalmente utilizado para descrever a emissão de vapor a partir de respiradouros receptores de condensado e linhas abertas de descarga de condensado a partir de purgadores de vapor. Como pode formar-se vapor de água sem adicionar calor?
Flash steam occurs sempre que a água a alta pressão (e uma temperatura superior à temperatura de saturação do líquido a baixa pressão) é deixada cair para uma pressão mais baixa. Inversamente, se a temperatura da água a alta pressão for inferior à temperatura de saturação a baixa pressão, não se pode formar vapor de flash. No caso do condensado passar por um separador de vapor, é normalmente o caso de a temperatura a montante ser suficientemente elevada para formar vapor de flash. Ver imagem abaixo
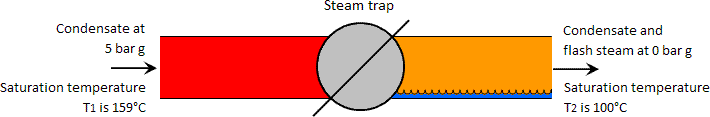
Considerar um quilograma de condensado a 5 bar g e uma temperatura de saturação de 159°C passando por um purgador a uma pressão mais baixa de 0 bar g. A quantidade de energia num quilograma de condensado à temperatura de saturação a 5 bar g é de 671 kJ. De acordo com a primeira lei da termodinâmica, a quantidade de energia contida no fluido no lado de baixa pressão do purgador deve ser igual à do lado de alta pressão, e constitui o princípio de conservação de energia.
Consequentemente, o calor contido num quilograma de fluido de baixa pressão é também 671 kJ. No entanto, a água a 0 bar g só é capaz de conter 419 kJ de calor, subsequentemente parece haver um desequilíbrio de calor no lado de baixa pressão de 671 – 419 = 252 kJ, o que, em termos de água, poderia ser considerado como excesso de calor.
Este excesso de calor ferve parte do condensado no que é conhecido como vapor flash e o processo de ebulição é chamado de flashing. Portanto, o quilograma de condensado que existia como um quilograma de água líquida no lado de alta pressão do purgador existe agora parcialmente como água e vapor no lado de baixa pressão.
A quantidade de vapor flash produzido à pressão final (P2) pode ser determinada utilizando:
Proporção de vapor flash = (hf em P1) – (hf em P2) / hfg em P2
- P1 = Pressão inicial
- P2 = Pressão final
- hf = Entalpia líquida (kJ/kg)
- hfg = Entalpia de evaporação (kJ/kg)
Exemplo: O caso em que a temperatura do condensado de alta pressão é superior à temperatura de saturação de baixa pressão.
Considerar uma quantidade de água a uma pressão de 5 bar g, contendo 671 kJ/kg de energia térmica à sua temperatura de saturação de 159°C. Se a pressão fosse então reduzida até à pressão atmosférica (0 bar g), a água só poderia existir a 100°C e conter 419 kJ/kg de energia calorífica. Esta diferença de 671 – 419 = 252 kJ/kg de energia térmica, produziria então vapor flash à pressão atmosférica.
670.9 – 419.0
2257.0
670.9 – 419,0
0,11 kg vapor / kg água
A proporção de vapor flash produzido pode ser considerada como a razão entre o excesso de energia e a entalpia de evaporação à pressão final.
Exemplo: O caso em que a temperatura de condensação a alta pressão é inferior à temperatura de saturação a baixa pressão.
Temperatura está a 90°C, ou seja, subarrefecida abaixo da temperatura de saturação atmosférica de 100°C. Nota: Normalmente não é prático para uma queda tão grande da temperatura do condensado da sua temperatura de saturação (neste caso 159°C a 90°C); está simplesmente a ser utilizado para ilustrar o ponto sobre o vapor flash não ser produzido em tais circunstâncias.
Neste caso, o lençol freático sub-saturado mostrará que a entalpia líquida de um quilograma de condensado a 5 barg e 90°C é de 377 kJ. Como esta entalpia é inferior à entalpia de um quilograma de água saturada à pressão atmosférica (419 kJ), não há excesso de calor disponível para produzir vapor flash. O condensado passa simplesmente através da armadilha e permanece num estado líquido à mesma temperatura mas a uma pressão atmosférica mais baixa, neste caso, a pressão atmosférica. Ver imagem abaixo.
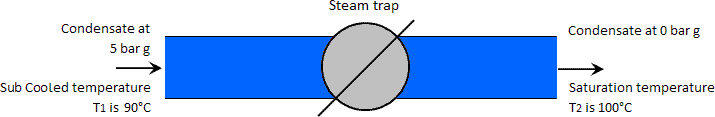
A pressão de vapor da água a 90°C é de 0,7 bar absoluto. Se a pressão de condensação mais baixa tivesse sido inferior a isto, teria sido produzido vapor de flash.
Os princípios de conservação de energia e massa entre dois estados do processo.
Os princípios de conservação de energia e massa permitem pensar no fenómeno do vapor de flash a partir de uma direcção diferente.
1 kg de condensado a 5 bar g e 159°C produz 0,112 kg de vapor de flash à pressão atmosférica. Isto pode ser ilustrado esquematicamente na tabela abaixo. A massa total de flash e condensado permanece a 1 kg.
1 kg de condensado
159°C
Enthalpy 671 kJ
 Aparador de vapor
Aparador de vapor0.112 vapor flash
0,888 condensado
O princípio da conservação de energia afirma que a energia total no estado de baixa pressão deve ser igual à energia total no estado de alta pressão. Portanto, a quantidade de calor no vapor de flash e condensado deve ser igual à do condensado inicial de 671 kJ.
As tabelas de vapor dão as seguintes informações:
- Entalpia total da água saturada à pressão atmosférica (hf) = 419 kJ/kg
- Entalpia total do vapor saturado à pressão atmosférica (hg) = 2 675 kJ/kg
- Assim, no estado de pressão mais baixa de 0 bar g
- Entalpia total da água = 0.888 kg x 419 kJ / kg = 372 kJ (A)
- Entalpia total no vapor = 0.112 kg x 2 675 kJ / kg = 299 kJ (B)
- Entalpia total no condensado e vapor a baixa pressão = A + B = 671 kJ
Por isso, as tabelas de vapor, a entalpia esperada no estado de baixa pressão é a mesma que no estado de alta pressão, provando assim o princípio de conservação de energia.
Geral
Vapor saturado
Vapor de água é vapor de água. A uma dada temperatura, existe uma certa pressão de vapor em equilíbrio com a água líquida. Isso é vapor “húmido” ou vapor saturado. Se a temperatura do vapor exceder a temperatura em que está em equilíbrio com uma dada pressão de vapor de água, o vapor é superaquecido (aquecido acima da temperatura correspondente à pressão de vapor de equilíbrio) e o vapor é referido como “seco”. Conhecendo a pressão, a temperatura também é conhecida.
vapor superaquecido
Se o vapor saturado for mais aquecido, a humidade diminuirá. As gotículas de água restantes são mais pequenas e passam para a fase de vapor. A temperaturas de 10-20°C acima da temperatura do vapor saturado ocorreu um sobreaquecimento.
Due to the poor Heat Transfer vapor sobreaquecido é melhor para o transporte de calor (fluxo de vapor em condutas longas).
Due to the good Heat Transfer vapor saturado é melhor para a transferência de calor (aquecimento de permutadores de calor vapor saturado deve ser utilizado).
Flash steam
Flash steam is released from hot condensate when its pressure is reduced. Mesmo água a uma temperatura ambiente de 20°C ferveria se a sua pressão fosse suficientemente reduzida. Pode valer a pena notar que a água a 170°C ferverá a qualquer pressão abaixo de 6,9 bar g. O vapor libertado pelo processo de flashing é tão útil como o vapor libertado de uma caldeira de vapor.
Como exemplo, quando o vapor é retirado de uma caldeira e a pressão da caldeira cai, parte do conteúdo de água da caldeira irá piscar para complementar o vapor “vivo” produzido pelo calor do combustível da caldeira. Como ambos os tipos de vapor são produzidos na caldeira, é impossível diferenciá-los entre si. Apenas quando a intermitência ocorre a uma pressão relativamente baixa, tal como no lado de descarga dos purgadores, é que o termo vapor intermitente é amplamente utilizado. Infelizmente, esta utilização levou à conclusão errada de que o vapor de flash é de alguma forma menos valioso do que o chamado vapor vivo.
Em qualquer sistema de vapor que procure maximizar a eficiência, o vapor de flash será separado do condensado, e utilizado para complementar qualquer aplicação de aquecimento a baixa pressão. Cada quilograma de vapor de clarão utilizado desta forma é um quilograma de vapor que não precisa de ser fornecido pela caldeira. É também um quilograma de vapor não ventilado para a atmosfera, de onde de outra forma seria perdido.
As razões para a recuperação do vapor flash são tão convincentes, tanto económica como ambientalmente, como as razões para a recuperação do condensado.
Nota:
O estado do vapor é determinado por três variáveis:
- Pressão do vapor
- Temperatura do vapor
- Volume do vapor, que depende da pressão e da temperatura
A pressão e a temperatura do vapor podem ser medidas com relativa facilidade. O volume de vapor pode olhar para uma referência semelhante.
Custos energéticos crescentes
Em tempos de custos energéticos crescentes, para o operador de um sistema de vapor e condensado de energia intensiva, é importante compreender os processos termodinâmicos por vezes bastante sofisticados. O mesmo sistema de vapor e condensado, que ainda era tratado há alguns anos atrás bastante trivial, deve-se agora aos preços mais elevados da energia, que de repente são o centro das atenções.
A melhor maneira de identificar problemas, tem o operador. Ele está todos os dias nas instalações e deve estar familiarizado com cada Válvula e cada bomba. As competências são muitas vezes suficientes para verificar o consumo de energia de uma instalação e optimizar o sentido técnico.
As medidas de poupança de energia podem ser implementadas já em pequenas medidas. A primeira medida de poupança de energia, que o operador deve rever o seu sistema para determinar se as bombas, válvulas de controlo, permutadores de calor, etc., correspondem realmente às condições para as quais foram originalmente concebidas. Isto requer que o operador conheça o seu sistema e compreenda as relações básicas.