Química Introdutiva
Objectivos de Aprendizagem
No final desta secção, poderá fazê-lo:
- li>Prever as estruturas de pequenas moléculas utilizando a teoria da repulsão de pares de electrões de conchas de valência (VSEPR)/ul>
Até aqui, utilizámos estruturas bidimensionais de Lewis para representar moléculas. Contudo, a estrutura molecular é na realidade tridimensional, e é importante ser capaz de descrever ligações moleculares em termos das suas distâncias, ângulos, e arranjos relativos no espaço (Figura 1). Um ângulo de ligação é o ângulo entre quaisquer duas ligações que incluem um átomo comum, geralmente medido em graus. Uma distância de ligação (ou comprimento de ligação) é a distância entre os núcleos de dois átomos ligados ao longo da linha recta que une os núcleos. As distâncias de ligação são medidas em Ångstroms (1 Å = 10-10 m) ou picómetros (1 pm = 10-12 m, 100 pm = 1 Å).
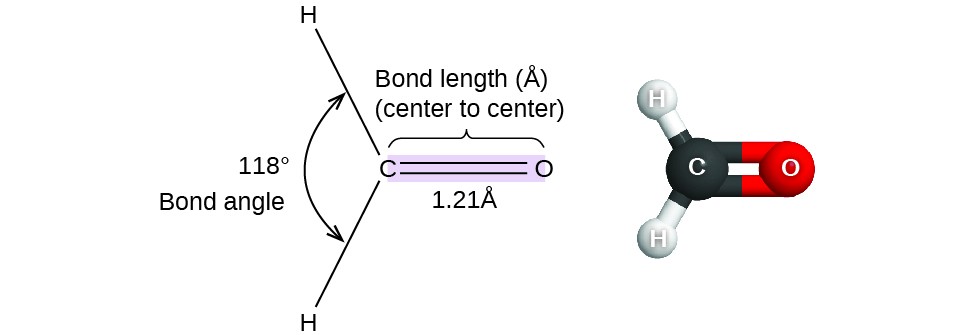
Figure 1. As distâncias de ligação (comprimentos) e ângulos são mostrados para a molécula de formaldeído, H2CO.
Teoria VSEPR
Teoria de repulsão de pares de electrões de concha de valência (teoria VSEPR) permite-nos prever a estrutura molecular, incluindo ângulos de ligação aproximados em torno de um átomo central, de uma molécula a partir de um exame do número de ligações e pares de electrões solitários na sua estrutura Lewis. O modelo VSEPR assume que os pares de electrões na concha de valência de um átomo central adoptarão um arranjo que minimize as repulsões entre estes pares de electrões, maximizando a distância entre eles. Os electrões na concha de valência de um átomo central ou formam pares de electrões de ligação, localizados principalmente entre átomos ligados, ou pares solitários. A repulsão electrostática destes electrões é reduzida quando as várias regiões de alta densidade de electrões assumem posições tão afastadas umas das outras quanto possível.
A teoria VSEPR prevê a disposição dos pares de electrões em torno de cada átomo central e, normalmente, a disposição correcta dos átomos numa molécula. Devemos compreender, contudo, que a teoria considera apenas as repulsões dos pares de electrões. Outras interacções, tais como repulsões nucleares-nucleares e atracções nucleares-electrónicas, estão também envolvidas na disposição final que os átomos adoptam numa determinada estrutura molecular.
Como exemplo simples da teoria VSEPR, vamos prever a estrutura de uma molécula gasosa de CO2. A estrutura de CO2 de Lewis (Figura 2) mostra apenas dois pares de electrões em torno do átomo central de carbono. Com duas ligações e nenhum par de electrões solitários no átomo central, as ligações estão o mais afastadas possível, e a repulsão electrostática entre estas regiões de alta densidade de electrões é reduzida ao mínimo quando estão em lados opostos do átomo central. O ângulo de ligação é de 180° (Figura 2). A figura 3 ilustra esta e outras geometrias de pares de electrões que minimizam as repulsões entre regiões de alta densidade de electrões (ligações e/ou pares solitários). Duas regiões de densidade de electrões em torno de um átomo central numa molécula formam uma geometria linear; três regiões formam uma geometria planar trigonal; quatro regiões formam uma geometria tetraédrica; cinco regiões formam uma geometria bipiramidal trigonal; e seis regiões formam uma geometria octaédrica.

Figure 2. O dióxido de carbono adopta uma estrutura linear em que as duas ligações estão o mais afastadas possível, em lados opostos do átomo C

Figure 3 Basic electron-pair geometries predicted by VSEPR theory maximize o espaço em torno de qualquer região de densidade de electrões (ligações ou pares solitários).
Geometria de Par de electrões versus Estrutura Molecular
É importante notar que a geometria de pares de electrões em torno de um átomo central não é a mesma coisa que a sua estrutura molecular. As geometrias de pares de electrões mostradas na Figura 3 descrevem todas as regiões onde os electrões estão localizados, ligações, bem como pares solitários. A estrutura molecular descreve a localização dos átomos, não dos electrões.

Figure 4. A estrutura molecular da molécula de metano, CH4, é mostrada com uma disposição tetraédrica dos átomos de hidrogénio.
Diferenciamos entre estas duas situações nomeando a geometria que inclui todos os pares de electrões a geometria dos pares de electrões. A estrutura que inclui apenas a colocação dos átomos na molécula é chamada de estrutura molecular. As geometrias dos pares de electrões serão as mesmas que as estruturas moleculares quando não houver pares de electrões solitários em torno do átomo central, mas serão diferentes quando houver pares solitários presentes no átomo central.
estruturas VSEPR como a da Figura 4 são frequentemente desenhadas usando a notação de cunha e traço, em que linhas sólidas representam ligações no plano da página, cunhas sólidas representam ligações que saem do plano, e linhas tracejadas representam ligações que descem para o plano. Por exemplo, a molécula de metano, CH4, que é o principal componente do gás natural, tem quatro pares de electrões de ligação em torno do átomo central de carbono; a geometria dos pares de electrões é tetraédrica, tal como a estrutura molecular (Figura 4). Por outro lado, a molécula de amoníaco, NH3, também tem quatro pares de electrões associados ao átomo de azoto, e por isso tem uma geometria tetraédrica de par de electrões. Uma destas regiões, contudo, é um par isolado, que não está incluído na estrutura molecular, e este par isolado influencia a forma da molécula (Figura 5).

Figure 5. (a) A geometria do par de electrões para a molécula de amoníaco é tetraédrica com um par único e três ligações únicas. (b) A estrutura molecular trigonal piramidal é determinada a partir da geometria do par de electrões. (c) Os ângulos reais de ligação desviam-se ligeiramente dos ângulos idealizados, porque o par solitário ocupa uma região maior de espaço do que as ligações simples, fazendo com que o ângulo HNH seja ligeiramente menor do que 109,5°.
Como se vê na Figura 5, pequenas distorções dos ângulos ideais da Figura 6 podem resultar de diferenças na repulsão entre várias regiões de densidade de electrões. A teoria VSEPR prevê estas distorções estabelecendo uma ordem de repulsões e uma ordem da quantidade de espaço ocupado por diferentes tipos de pares de electrões. A ordem das repulsões de pares de electrões da maior para a menor repulsão é:
par único par par par-único-par-único > par-único par-ligação de ligação > par-ligação de ligação
Esta ordem de repulsões determina a quantidade de espaço ocupado por diferentes regiões de electrões. Um par único de electrões ocupa uma região maior de espaço do que os electrões numa ligação tripla; por sua vez, os electrões de uma ligação tripla ocupam mais espaço do que os de uma ligação dupla, e assim por diante. A ordem de tamanhos é da maior para a menor:
par único > ligação tripla > ligação dupla> ligação única
Considerar formaldeído, H2CO, que é utilizado como conservante para espécimes biológicos e anatómicos (Figura 1). Esta molécula tem regiões de alta densidade de electrões que consistem em duas ligações simples e uma dupla ligação. A geometria básica é planar trigonal com ângulos de ligação de 120°, mas vemos que a ligação dupla causa ângulos ligeiramente maiores (121°), e o ângulo entre as ligações simples é ligeiramente menor (118°).
Na molécula de amoníaco, os três átomos de hidrogénio ligados ao azoto central não estão dispostos numa estrutura molecular planar trigonal plana, mas sim numa pirâmide trigonal tridimensional (Figura 5) com o átomo de azoto no ápice e os três átomos de hidrogénio formando a base. Os ângulos de ligação ideais numa pirâmide trigonal baseiam-se na geometria do par de electrões tetraédrico. Mais uma vez, há ligeiros desvios em relação ao ideal porque os pares solitários ocupam regiões maiores de espaço do que os electrões de ligação. Os ângulos de ligação H-N-H em NH3 são ligeiramente menores do que o ângulo de 109,5° num tetraedro regular (Figura 3) porque a repulsão do par solitário de ligação é maior do que a repulsão do par de ligação de ligação (Figura 5). A figura 6 ilustra as estruturas moleculares ideais, que são previstas com base nas geometrias de pares de electrões para várias combinações de pares solitários e pares de ligação.

Figure 6. As estruturas moleculares são idênticas às geometrias dos pares de electrões quando não há pares isolados presentes (primeira coluna). Para um número particular de pares de electrões (linha), as estruturas moleculares para um ou mais pares isolados são determinadas com base nas modificações da geometria correspondente dos pares de electrões.
Segundo a teoria VSEPR, as localizações dos átomos terminais (Xs na Figura 6) são equivalentes dentro das geometrias dos pares de electrões lineares, trigonais planares e tetraédricos (as três primeiras linhas da tabela). Não importa qual X é substituído por um par solitário, porque as moléculas podem ser rodadas para converter posições.
Previsão da Geometria de Par de Electrões e Estrutura Molecular
O procedimento seguinte utiliza a teoria VSEPR para determinar as geometrias dos pares de electrões e as estruturas moleculares:
- Escrever a estrutura Lewis da molécula ou ião poliatómico.
- Contar o número de regiões de densidade de electrões (pares solitários e ligações) em torno do átomo central. Uma ligação simples, dupla ou tripla conta como uma região de densidade de electrões.
li>Identificar a geometria do par de electrões com base no número de regiões de densidade de electrões: linear, planar trigonal, ou tetraédrico. (Figura 6, primeira coluna).li>Utilizar o número de pares isolados para determinar a estrutura molecular (Figura 6). Se for possível mais de um arranjo de pares solitários e ligações químicas, escolher o que minimizará as repulsões, lembrando que os pares solitários ocupam mais espaço do que as ligações múltiplas, que ocupam mais espaço do que as ligações simples.
Os exemplos seguintes ilustram o uso da teoria VSEPR para prever a estrutura molecular das moléculas ou iões que não têm pares solitários de electrões. Neste caso, a estrutura molecular é idêntica à geometria do par de electrões.
Exemplo 1: Previsão da Geometria do par de electrões e da Estrutura Molecular
Previsão da geometria do par de electrões e da estrutura molecular do fosgénio, COCl2, um agente de guerra química utilizado durante a Primeira Guerra Mundial
Os vários exemplos seguintes ilustram o efeito dos pares solitários de electrões na estrutura molecular.
Exemplo 2: Geometria Prevista de Par de Electrões e Estrutura Molecular: Pares solitários no Átomo Central
Prever a geometria do par de electrões e a estrutura molecular de uma molécula de água.
Exemplo 3: Simulação Molecular
Utilizar simulador de forma molecular permite-nos controlar se os ângulos de ligação e/ou pares solitários são exibidos, verificando ou desmarcando as caixas em “Opções” à direita. Podemos também usar as caixas de verificação “Nome” na parte inferior esquerda para exibir ou ocultar a geometria do par de electrões (chamada “geometria de electrões” no simulador) e/ou estrutura molecular (chamada “forma molecular” no simulador).
Build the molecule HCN in the simulator based on the following Lewis structure:
\text{H-C}\equiv \text{N}
Click on each bond type or lone pair at right to add that group to the central atom. Assim que tiver a molécula completa, rode-a para examinar a estrutura molecular prevista. Que estrutura molecular é esta?
Conceitos Chave e Resumo
Teoria VSEPR prevê a disposição tridimensional dos átomos de uma molécula. Afirma que os electrões de valência assumirão uma geometria de pares de electrões que minimiza as repulsões entre áreas de alta densidade de electrões (ligações e/ou pares solitários). A estrutura molecular, que se refere apenas à colocação dos átomos numa molécula e não dos electrões, é equivalente à geometria do par de electrões apenas quando não há pares de electrões solitários em torno do átomo central.
Exercícios
- Explicar a diferença entre a geometria do par de electrões e a estrutura molecular.
- Porquê o ângulo H-N-H em NH3 é menor do que o ângulo de ligação H-C-H em CH4? Porque é que o ângulo H-N-H em {\texto{NH}}_{4}^{+} é idêntico ao ângulo de ligação H-C-H em CH4?
- CF4
- PCl3
- SeF4
- Identificar a geometria do par de electrões e a estrutura molecular de cada uma das seguintes moléculas:
- ClNO (N é o átomo central)
- Cl2CO (C é o átomo central)
- Cl2SO (S é o átomo central atom)
- Cl2SeO (Se é o átomo central)
- F2SO (S é o átomo central)
- Uma molécula com a fórmula AB2, em que A e B representam átomos diferentes, poderiam ter uma de três formas diferentes. Esboçar e nomear as três formas diferentes que esta molécula pode ter. Dar um exemplo de uma molécula ou íon para cada forma.
- Uma molécula com a fórmula AB3, na qual A e B representam átomos diferentes, poderia ter uma das três formas diferentes. Esboçar e nomear as três formas diferentes que esta molécula pode ter. Dar um exemplo de uma molécula ou íon que tenha cada forma.
li>Identificar a geometria do par de electrões e a estrutura molecular de cada uma das seguintes moléculas:
li>Utilizar o simulador de forma de molécula PhET Molecule para construir uma molécula. Começando com o átomo central, clicar na ligação dupla para adicionar uma ligação dupla. Depois adicione uma única ligação e um único par. Rodar a molécula para observar a geometria completa. Nomear a geometria do grupo de electrões e a estrutura molecular e prever o ângulo de ligação. Depois clique nas caixas de verificação no fundo e à direita do simulador para verificar as suas respostas.li>Utilizar o simulador PhET Molecule Shape para explorar moléculas reais. No separador Real Molecules, seleccione H2O. Alternar entre os modos “real” e “modelo”. Explique a diferença observada.li>Utiliza o simulador de PhET Molecule Shape para explorar moléculas reais. No separador Real Molecules, seleccionar o modo “modelo” e S2O. Qual é o ângulo de ligação do modelo? Explique se o ângulo de ligação “real” deve ser maior ou menor que o ângulo ideal do modelo./ol>
Glossary
ângulo de ligação: ângulo entre quaisquer duas ligações covalentes que partilham um átomo comum
distância de ligação: (também, comprimento da ligação) distância entre os núcleos de dois átomos ligados
geometria do par de electrões: disposição em torno de um átomo central de todas as regiões de densidade de electrões (ligações, pares isolados, ou electrões não reparados)
linear: forma em que dois grupos exteriores são colocados em lados opostos de um átomo central
estrutura molecular: estrutura que inclui apenas a colocação dos átomos na molécula
tetraédrico: forma em que quatro grupos exteriores são colocados em torno de um átomo central, de tal forma que é gerada uma forma tridimensional com quatro cantos e 109.5° ângulos entre cada par e o átomo central
plano triangular: forma na qual três grupos exteriores são colocados num triângulo plano em torno de um átomo central com ângulos de 120° entre cada par e o átomo central
teoria de repulsão de pares de electrões de concha de valência (VSEPR): teoria utilizada para prever os ângulos de ligação numa molécula com base no posicionamento de regiões de alta densidade de electrões o mais afastadas possível para minimizar a repulsão electrostática
vector: quantidade com magnitude e direcção


