Warum leiten Metalle Wärme und Elektrizität so gut? Welche Metalle leiten am besten?
Struktur von Metallen
Die Strukturen von reinen Metallen sind einfach zu beschreiben, da die Atome, die diese Metalle bilden, als identische perfekte Kugeln gedacht werden können. Genauer gesagt besteht die metallische Struktur aus „ausgerichteten positiven Ionen“ (Kationen) in einem „Meer“ von delokalisierten Elektronen. Das bedeutet, dass sich die Elektronen frei in der Struktur bewegen können, was zu Eigenschaften wie Leitfähigkeit führt.
Was sind verschiedene Arten von Bindungen?
Kovalente Bindungen
Eine kovalente Bindung ist eine Bindung, die entsteht, wenn zwei Atome Elektronen teilen. Beispiele für Verbindungen mit kovalenten Bindungen sind Wasser, Zucker und Kohlendioxid.
Ionische Bindungen
Eine ionische Bindung ist die vollständige Übertragung von Valenzelektronen zwischen einem Metall und einem Nichtmetall. Dadurch entstehen zwei gegensätzlich geladene Ionen, die sich gegenseitig anziehen. Bei einer ionischen Bindung verliert das Metall Elektronen und wird zu einem positiv geladenen Kation, während das Nichtmetall diese Elektronen aufnimmt und zu einem negativ geladenen Anion wird. Ein Beispiel für eine Ionenbindung wäre Salz (NaCl).
Metallische Bindungen
Metallische Bindungen sind das Ergebnis der elektrostatischen Anziehungskraft, die zwischen Leitungselektronen (in Form einer Elektronenwolke aus delokalisierten Elektronen) und positiv geladenen Metallionen auftritt. Sie kann als die gemeinsame Nutzung von freien Elektronen in einem Gitter von positiv geladenen Ionen (Kationen) beschrieben werden. Metallische Bindungen sind für viele physikalische Eigenschaften von Metallen verantwortlich, wie z.B. Festigkeit, Duktilität, thermischer und elektrischer Widerstand und Leitfähigkeit, Opazität und Glanz.
Delokalisierte, bewegliche Elektronen in Metallen —
Es ist die freie Bewegung der Elektronen in Metallen, die ihnen ihre Leitfähigkeit verleiht.
Elektrische Leitfähigkeit
Metalle enthalten frei bewegliche delokalisierte Elektronen. Wenn eine elektrische Spannung angelegt wird, löst ein elektrisches Feld innerhalb des Metalls die Bewegung der Elektronen aus, so dass sie sich von einem Ende zum anderen Ende des Leiters bewegen. Die Elektronen bewegen sich in Richtung der positiven Seite.
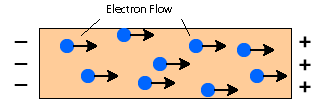
Wärmeleitung
Metall ist ein guter Wärmeleiter. Wärmeleitung tritt auf, wenn eine Substanz erhitzt wird, gewinnen die Teilchen mehr Energie und schwingen mehr. Diese Moleküle stoßen dann auf benachbarte Teilchen und übertragen einen Teil ihrer Energie auf diese. Dies setzt sich dann fort und gibt die Energie vom heißen Ende an das kältere Ende der Substanz weiter.
Warum leiten Metalle Wärme so gut?
Die Elektronen in Metallen sind delokalisierte Elektronen und sind frei bewegliche Elektronen. Wenn sie also Energie (Wärme) gewinnen, schwingen sie schneller und können sich bewegen, was bedeutet, dass sie die Energie schneller weitergeben können.
Welche Metalle leiten am besten?
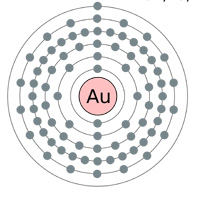
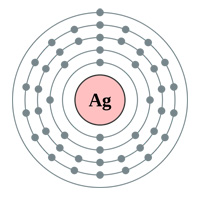
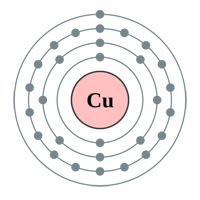
Oben: Elektronenhüllen Gold (au), Silber (Ag), Kupfer (Cu) und Zink (Zn). Die Logik würde einen denken lassen, dass Gold der beste Leiter ist, da es ein einzelnes s-Orbitalelektron in der letzten Schale hat (obiges Diagramm) … warum also sind Silber und Kupfer tatsächlich besser (siehe Tabelle unten).
|
Leitfähigkeit der Metalle
|
>S/m
|
| Silber | 6.30×10 7 |
| Kupfer | 5,96×10 7 |
| Gold | 4.10×10 7 |
| Aluminium | 3,50×10 7 |
| Zink | 1.69×10 7 |
Silber hat einen größeren Atomradius (160 pm) als Gold (135 pm), obwohl Gold mehr Elektronen hat als Silber! Einen Grund dafür finden Sie im Kommentar unten.
Hinweis: Silber ist ein besserer Leiter als Gold, aber Gold ist begehrter, weil es nicht korrodiert. (Kupfer ist am gebräuchlichsten, weil es am kostengünstigsten ist) Die Antwort ist ein bisschen kompliziert und wir stellen hier eine der besten Antworten, die wir gesehen haben, für diejenigen, die mit dem Material vertraut sind…
„Silber befindet sich in der Mitte der Übergangsmetalle, etwa auf halber Strecke zwischen den Edelgasen und den Alkalimetallen. In Spalte 11 des Periodensystems haben alle diese Elemente (Kupfer, Silber und Gold) ein einzelnes s-Orbital-Elektron in der äußeren Schale (Platin hat das auch, in Spalte 10).
Die Orbitalstruktur der Elektronen dieser Elemente hat keine besondere Affinität, ein Elektron zu den schwereren oder leichteren Edelgasen zu gewinnen oder zu verlieren, da sie 1/2 dazwischen sitzen. Im Allgemeinen bedeutet dies, dass es nicht viel Energie braucht, um ein Elektron vorübergehend abzuschlagen oder eines hinzuzufügen. Die spezifischen Elektronenaffinitäten und Ionisationspotentiale sind unterschiedlich, und für die Leitung ist es einigermaßen wichtig, relativ niedrige Energien für diese beiden Kriterien zu haben.
Wenn das die einzigen Kriterien wären, dann wäre Gold ein besserer Leiter als Silber, aber Gold hat zusätzlich zu den 10 d-Orbitalelektronen und dem einzelnen s-Orbitalelektron 14 f-Orbitalelektronen. Die 14 f-Elektronen sind auf die zusätzlichen Atome in der Aktinidenreihe zurückzuführen. Mit 14 zusätzlichen Elektronen, die anscheinend auf die d- und s-Elektronen drängen, würde man denken, dass das s-Elektron einfach da draußen sitzt und „reif“ für die Leitung ist (kaum Energie ist nötig, um es abzustoßen), aber NEIN. Die f-Orbital-Elektronen sind so gepackt, dass der Atomradius von Gold tatsächlich KLEINER ist als der Atomradius von Silber – nicht um viel, aber er ist kleiner. Ein kleinerer Radius bedeutet mehr Kraft vom Kern auf die äußeren Elektronen, so dass Silber den Leitfähigkeits-„Wettbewerb“ gewinnt. Denken Sie daran, dass die Kraft aufgrund der elektrischen Ladung umgekehrt proportional zum Quadrat des Abstands ist. Je näher 2 Ladungen beieinander sind, desto größer ist die Kraft zwischen ihnen.
Beide, Kupfer und Platin, haben noch kleinere Durchmesser; daher mehr Anziehungskraft vom Kern, daher mehr Energie, um das einsame s-Elektron abzustoßen, daher geringere Leitfähigkeit.
Andere Elemente mit einem einzelnen s-Orbital-Elektron, das dort draußen „reif für den Leitungspicker“ sitzt, haben ebenfalls kleinere Atomradien (Molybdän, Niob, Chrom, Ruthenium, Rhodium) als Silber.
So ist es vor allem, wo es sitzt – wo ‚Mutter Natur‘ Silber im Periodensystem platziert hat, das diktiert seine ausgezeichnete Leitfähigkeit.“
Quelle von tlbs101 Yahoo