Cristallizzazione
La cristallizzazione è una tecnica che i chimici usano per purificare i composti solidi. È una delle procedure fondamentali che ogni chimico deve padroneggiare per diventare abile in laboratorio. La cristallizzazione si basa sui principi della solubilità: i composti (soluti) tendono ad essere più solubili in liquidi caldi (solventi) che in liquidi freddi. Se una soluzione calda satura viene lasciata raffreddare, il soluto non è più solubile nel solvente e forma cristalli di composto puro. Le impurità sono escluse dai cristalli in crescita e i cristalli solidi puri possono essere separati dalle impurità dissolte per filtrazione.
Questa descrizione scientifica semplificata della cristallizzazione non dà un quadro realistico di come il processo si realizza in laboratorio. Piuttosto, la cristallizzazione di successo si basa su una miscela di scienza e arte; il suo successo dipende più dalla sperimentazione, dall’osservazione, dall’immaginazione e dall’abilità che dalle previsioni matematiche e fisiche. Comprendere il processo di cristallizzazione di per sé non farà di uno studente un maestro cristallizzatore; questa comprensione deve essere combinata con la pratica di laboratorio per acquisire competenza in questa tecnica.
Cosa succede durante una cristallizzazione
Per cristallizzare un composto impuro e solido, aggiungere solo abbastanza solvente caldo per dissolverlo completamente. Il pallone contiene quindi una soluzione calda, in cui le molecole di soluto – sia il composto desiderato che le impurità – si muovono liberamente tra le molecole di solvente caldo. Mentre la soluzione si raffredda, il solvente non può più trattenere tutte le molecole di soluto, ed esse cominciano a lasciare la soluzione e a formare cristalli solidi. Durante questo raffreddamento, ogni molecola di soluto si avvicina a sua volta a un cristallo in crescita e si appoggia sulla superficie del cristallo. Se la geometria della molecola si adatta a quella del cristallo, sarà più probabile che rimanga sul cristallo piuttosto che tornare nella soluzione. Pertanto, ogni cristallo in crescita consiste di un solo tipo di molecola, il soluto. Dopo che la soluzione è arrivata a temperatura ambiente, viene accuratamente messa in un bagno di ghiaccio per completare il processo di cristallizzazione. La soluzione raffreddata viene poi filtrata per isolare i cristalli puri e i cristalli vengono risciacquati con solvente raffreddato.
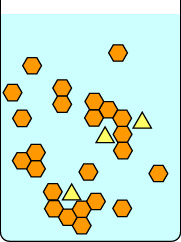
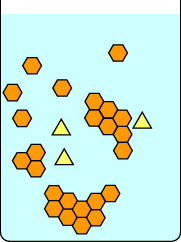
Questa prima serie di diagrammi mostra cosa succede se si lascia che una cristallizzazione proceda lentamente: prima impostando la beuta a temperatura ambiente indisturbata fino alla formazione dei cristalli, e poi con attenzione sul ghiaccio. La barra rossa a destra di ogni immagine è un termometro, per indicare la temperatura. I triangoli gialli sono un’impurità nella soluzione calda di esagoni arancioni. Se la soluzione viene lasciata raffreddare lentamente, le impurità possono attaccarsi brevemente al reticolo cristallino in crescita, ma se ne vanno presto mentre un composto con una geometria più adatta viene a prendere il loro posto. Gli esagoni adatti rimangono più facilmente nel reticolo in crescita, e alla fine si formano cristalli puri di esagoni arancioni.
  |
  |
  |
  |
||||
1 |
2 |
3 |
4 |
||||
  |
  |
||||||
5 |
6 |
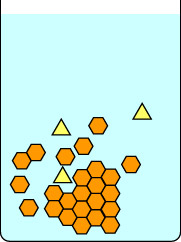
Questa seconda serie di diagrammi mostra cosa succede se si raffredda la soluzione troppo velocemente. Le impurità del triangolo giallo sono intrappolate all’interno dei cristalli che si stanno formando dagli esagoni arancioni, quindi i cristalli isolati sono impuri. Nota che una cristallizzazione lenta dà cristalli più grandi di una cristallizzazione veloce. I cristalli piccoli hanno una grande superficie in rapporto al volume e le impurità sono situate sulla superficie dei cristalli così come intrappolate all’interno della matrice.
  |
  |
  |
  |
||||
1 |
2 |
3 |
4 |
Come Per fare una cristallizzazione
 |
Scaldare del solvente fino all’ebollizione (ricordarsi di usare un chip di ebollizione). Mettere il solido da ricristallizzare in una beuta. |
 |
Versare una piccola quantità di solvente caldo nella beuta contenente il solido. |
 |
Rivolgere il pallone per sciogliere il solido. |
 |
Porre il pallone sul bagno di vapore per mantenere la soluzione calda. |
 |
Se il solido non è ancora sciolto, aggiungere una piccola quantità di solvente e agitare di nuovo. |
 |
Quando il solido è tutto in soluzione, metterlo sul banco. Non disturbarlo! |
 |
Dopo un po’, i cristalli dovrebbero apparire nella beuta. |
 |
Ora puoi mettere la beuta in un bagno di ghiaccio per finire il processo di cristallizzazione. |
 |
Sei ora pronto per filtrare la soluzione per isolare i cristalli. Si prega di vedere la sezione sulla filtrazione sotto vuoto. Rimuovere la carta da filtro dall’imbuto Buchner quando fatto. |
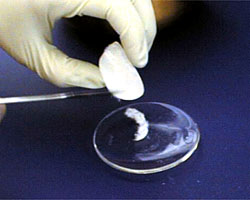 |
Dopo che i cristalli sono filtrati dalla soluzione, metterli su un vetro d’orologio. |
 |
Lasciate che il cristallo finisca di asciugarsi sul vetro d’orologio. |
Film sulla cristallizzazione
CU Organic Chemistry ha prodotto un film sulla cristallizzazione.
Quiz sulla tecnica di cristallizzazione
Vedi quanto hai capito la cristallizzazione facendo il quiz online sulla tecnica di cristallizzazione!