Kristallisation
Die Kristallisation ist eine Technik, die Chemiker zur Reinigung von festen Verbindungen verwenden. Es ist eines der grundlegenden Verfahren, die jeder Chemiker beherrschen muss, um im Labor kompetent zu sein. Die Kristallisation basiert auf dem Prinzip der Löslichkeit: Verbindungen (gelöste Stoffe) neigen dazu, in heißen Flüssigkeiten (Lösungsmitteln) besser löslich zu sein als in kalten Flüssigkeiten. Lässt man eine gesättigte heiße Lösung abkühlen, so ist der gelöste Stoff nicht mehr im Lösungsmittel löslich und bildet Kristalle der reinen Verbindung. Verunreinigungen werden von den wachsenden Kristallen ausgeschlossen und die reinen festen Kristalle können durch Filtration von den gelösten Verunreinigungen getrennt werden.
Diese vereinfachte wissenschaftliche Beschreibung der Kristallisation gibt kein realistisches Bild davon, wie der Prozess im Labor durchgeführt wird. Vielmehr beruht eine erfolgreiche Kristallisation auf einer Mischung aus Wissenschaft und Kunst; ihr Erfolg hängt mehr von Experimenten, Beobachtung, Vorstellungskraft und Geschick ab als von mathematischen und physikalischen Vorhersagen. Das Verständnis des Prozesses der Kristallisation an sich wird einen Studenten nicht zu einem Meister der Kristallisation machen; dieses Verständnis muss mit Laborpraxis kombiniert werden, um diese Technik zu beherrschen.
Was passiert während einer Kristallisation
Um eine unreine, feste Verbindung zu kristallisieren, gibt man gerade so viel heißes Lösungsmittel dazu, dass sie sich vollständig auflöst. Der Kolben enthält dann eine heiße Lösung, in der sich die gelösten Moleküle – sowohl die gewünschte Verbindung als auch Verunreinigungen – frei zwischen den heißen Lösungsmittelmolekülen bewegen. Wenn die Lösung abkühlt, kann das Lösungsmittel nicht mehr alle gelösten Moleküle halten, und sie beginnen, die Lösung zu verlassen und feste Kristalle zu bilden. Während dieser Abkühlung nähert sich jedes gelöste Molekül der Reihe nach einem wachsenden Kristall und setzt sich auf der Kristalloberfläche ab. Wenn die Geometrie des Moleküls zu der des Kristalls passt, ist es wahrscheinlicher, dass es auf dem Kristall bleibt, als dass es zurück in die Lösung geht. Daher besteht jeder wachsende Kristall nur aus einer Art von Molekül, dem gelösten Stoff. Nachdem die Lösung auf Raumtemperatur gekommen ist, wird sie vorsichtig in ein Eisbad gestellt, um den Kristallisationsprozess abzuschließen. Die gekühlte Lösung wird dann filtriert, um die reinen Kristalle zu isolieren, und die Kristalle werden mit gekühltem Lösungsmittel gespült.
Diese erste Serie von Diagrammen zeigt, was passiert, wenn man eine Kristallisation langsam fortschreiten lässt: zunächst, indem man den Kolben bei Raumtemperatur ungestört stehen lässt, bis sich Kristalle bilden, und dann vorsichtig auf Eis stellt. Der rote Balken auf der rechten Seite jedes Bildes ist ein Thermometer, um die Temperatur anzuzeigen. Die gelben Dreiecke sind eine Verunreinigung in der heißen Lösung der orangen Sechsecke. Wenn man die Lösung langsam abkühlen lässt, können sich die Verunreinigungen kurz an das wachsende Kristallgitter anlagern, aber sie verschwinden bald wieder, da eine Verbindung mit einer geeigneteren Geometrie an ihre Stelle tritt. Geeignete Sechsecke bleiben leichter im wachsenden Gitter, und schließlich bilden sich reine Kristalle aus orangefarbenen Sechsecken.
  |
  |
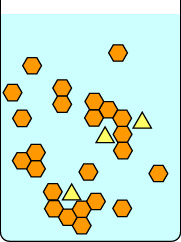  |
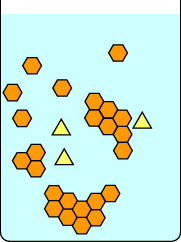  |
|||
1 |
2 |
3 |
4 |
|||
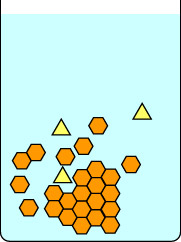  |
  |
|||||
5 |
6 |
Diese zweite Diagrammreihe zeigt, was passiert, wenn Sie die Lösung zu schnell abkühlen. Die Verunreinigungen in den gelben Dreiecken sind in den Kristallen eingeschlossen, die von den orangen Sechsecken gebildet werden, daher sind die isolierten Kristalle unrein. Beachten Sie, dass bei langsamer Kristallisation größere Kristalle entstehen als bei schneller Kristallisation. Kleine Kristalle haben ein großes Verhältnis von Oberfläche zu Volumen und Verunreinigungen befinden sich sowohl auf der Oberfläche der Kristalle als auch im Inneren der Matrix.
  |
  |
  |
  |
|||
1 |
2 |
3 |
4 |
Wie Eine Kristallisation durchführen
 |
Erhitzen Sie etwas Lösungsmittel bis zum Sieden (denken Sie daran, einen Siedechip zu verwenden). Geben Sie den umzukristallisierenden Feststoff in einen Erlenmeyerkolben. |
 |
Gießen Sie eine kleine Menge des heißen Lösungsmittels in den Kolben, der den Feststoff enthält. |
 |
Schwenken Sie den Kolben, um den Feststoff aufzulösen. |  |
Stellen Sie den Kolben auf das Dampfbad, um die Lösung warm zu halten. |
 |
Wenn der Feststoff immer noch nicht gelöst ist, fügen Sie eine winzige Menge mehr Lösungsmittel hinzu und schwenken Sie erneut. |
 |
Wenn der Feststoff vollständig in Lösung ist, stellen Sie ihn auf die Arbeitsfläche. Stören Sie ihn nicht! |
 |
Nach einer Weile sollten Kristalle im Kolben erscheinen. |
 |
Sie können den Kolben nun in ein Eisbad stellen, um den Kristallisationsprozess zu beenden. |
 |
Sie sind nun bereit, die Lösung zu filtrieren, um die Kristalle zu isolieren. Bitte beachten Sie den Abschnitt zur Vakuumfiltration. Entfernen Sie das Filterpapier aus dem Buchner-Trichter, wenn Sie fertig sind. |
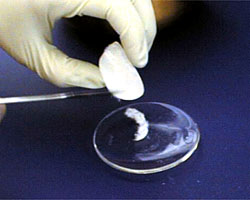 |
Nachdem Ihre Kristalle aus der Lösung filtriert wurden, legen Sie sie auf ein Uhrglas. |
 |
Lassen Sie die Kristalle auf dem Uhrglas fertig trocknen. |
Kristallisationsfilm
CU Organische Chemie hat einen Film über Kristallisation produziert.
Kristallisationstechnik-Quiz
Sehen Sie, wie gut Sie die Kristallisation verstehen, indem Sie das Online-Kristallisationstechnik-Quiz machen!