Kristallisatie
Kristallisatie is een techniek die chemici gebruiken om vaste verbindingen te zuiveren. Het is een van de fundamentele procedures die elke chemicus moet beheersen om bekwaam te worden in het laboratorium. Kristallisatie is gebaseerd op de principes van oplosbaarheid: verbindingen (oplosmiddelen) hebben de neiging beter oplosbaar te zijn in hete vloeistoffen (oplosmiddelen) dan in koude vloeistoffen. Als men een verzadigde hete oplossing laat afkoelen, is de opgeloste stof niet langer oplosbaar in het oplosmiddel en vormt kristallen van de zuivere verbinding. Onzuiverheden worden uit de groeiende kristallen geweerd en de zuivere vaste kristallen kunnen door filtratie van de opgeloste onzuiverheden worden gescheiden.
Deze vereenvoudigde wetenschappelijke beschrijving van kristallisatie geeft geen realistisch beeld van hoe het proces in het laboratorium wordt volbracht. Succesvolle kristallisatie berust veeleer op een mengeling van wetenschap en kunst; het succes ervan hangt meer af van experimenteren, observatie, verbeeldingskracht en vaardigheid dan van wiskundige en natuurkundige voorspellingen. Het begrijpen van het kristallisatieproces op zich zal van een student geen meester-kristallisator maken; dit begrip moet gecombineerd worden met laboratoriumpraktijk om vaardigheid in deze techniek te krijgen.
Wat gebeurt er tijdens een kristallisatie
Om een onzuivere, vaste verbinding te kristalliseren, voeg je net genoeg heet oplosmiddel toe om het volledig op te lossen. De kolf bevat dan een hete oplossing, waarin de moleculen van het oplosmiddel – zowel de gewenste verbinding als onzuiverheden – vrij bewegen tussen de hete moleculen van het oplosmiddel. Wanneer de oplossing afkoelt, kan het oplosmiddel niet langer alle moleculen van de opgeloste stof vasthouden en beginnen ze de oplossing te verlaten en vaste kristallen te vormen. Tijdens deze afkoeling nadert elke opgeloste molecule op zijn beurt een groeiend kristal en rust op het kristaloppervlak. Als de geometrie van het molecuul past bij die van het kristal, is de kans groter dat het molecuul op het kristal blijft dan dat het teruggaat in de oplossing. Daarom bestaat elk groeiend kristal slechts uit één type molecule, de opgeloste stof. Nadat de oplossing op kamertemperatuur is gekomen, wordt zij voorzichtig in een ijsbad geplaatst om het kristallisatieproces te voltooien. De gekoelde oplossing wordt dan gefiltreerd om de zuivere kristallen te isoleren en de kristallen worden gespoeld met gekoeld oplosmiddel.
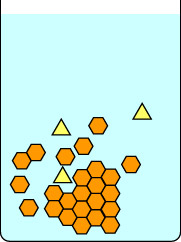
Deze eerste serie diagrammen laat zien wat er gebeurt als je een kristallisatie langzaam laat verlopen: eerst door de kolf ongestoord bij kamertemperatuur te zetten totdat zich kristallen vormen, en daarna voorzichtig op ijs. De rode balk rechts van elk diagram is een thermometer, om de temperatuur aan te geven. De gele driehoekjes zijn een onzuiverheid in de hete oplossing van oranje zeshoekjes. Als men de oplossing langzaam laat afkoelen, kunnen de onzuiverheden zich even hechten aan het groeiende kristalrooster, maar ze gaan snel weer weg als een verbinding met een geschiktere geometrie hun plaats inneemt. Geschikte hexagonen blijven gemakkelijker in het groeiende rooster, en uiteindelijk worden zuivere kristallen van oranje hexagonen gevormd.
  |
  |
  |
  |
|||
1 |
2 |
3 |
4 |
|||
  |
||||||
5 |
6 |
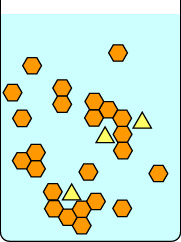
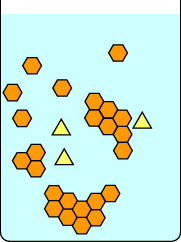
Deze tweede serie diagrammen laat zien wat er gebeurt als je de oplossing te snel afkoelt. De onzuiverheden in de gele driehoekjes zitten opgesloten in de kristallen die gevormd worden door de oranje zeshoekjes, dus de geïsoleerde kristallen zijn onzuiver. Merk op dat langzame kristallisatie grotere kristallen geeft dan snelle kristallisatie. Kleine kristallen hebben een grote oppervlakte-volumeverhouding en onzuiverheden bevinden zich zowel aan het oppervlak van de kristallen als in de matrix.
  |
  |
  |
  |
|||
1 |
2 |
3 |
4 |
Hoe Een kristallisatie uitvoeren
 |
Verwarm wat oplosmiddel tot het kookpunt (denk eraan een kookspaan te gebruiken). Doe de te herkristalliseren vaste stof in een erlenmeyer. |
 |
Giet een kleine hoeveelheid van het hete oplosmiddel in de kolf met de vaste stof. |
 |
Wentel de erlenmeyer om de vaste stof op te lossen. |
 |
Plaats de erlenmeyer op het stoombad om de oplossing warm te houden. |
 |
Als de vaste stof nog steeds niet is opgelost, voeg dan een heel klein beetje meer oplosmiddel toe en zwenk nogmaals. |
 |
Als de vaste stof helemaal is opgelost, zet hem dan op het werkblad. Niet storen! |
 |
Na enige tijd zouden er kristallen in de kolf moeten verschijnen. |
 |
Je kunt de erlenmeyer nu in een ijsbad plaatsen om het kristallisatieproces te voltooien. |
 |
Je bent nu klaar om de oplossing te filtreren om de kristallen te isoleren. Zie het gedeelte over vacuümfiltratie. Verwijder het filtreerpapier uit de Buchner trechter als je klaar bent. |
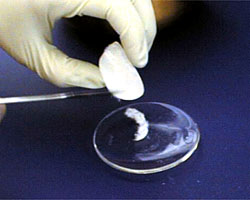 |
Als je kristallen uit de oplossing hebt gefilterd, leg je ze op een horlogeglas. |
 |
Laat de kristallen op het horlogeglas opdrogen. |
Kristallisatie Film
CU Organische Chemie heeft een film gemaakt over kristallisatie.
Kristallisatietechniek Quiz
Zie hoe goed jij kristallisatie begrijpt door de online Kristallisatietechniek Quiz te doen!