Papierchromatographie
Das Papier wird in einen Behälter gehängt, in dem sich eine flache Schicht eines geeigneten Lösungsmittels oder Lösungsmittelgemisches befindet. Es ist wichtig, dass der Pegel des Lösungsmittels unterhalb der Linie mit den Punkten darauf liegt. Das nächste Diagramm zeigt keine Details, wie das Papier aufgehängt wird, weil es zu viele Möglichkeiten gibt und das Diagramm dadurch unübersichtlich wird. Manchmal wird das Papier einfach zu einem losen Zylinder aufgerollt und oben und unten mit Büroklammern befestigt. Der Zylinder steht dann einfach im Boden des Behälters.
Der Grund für das Abdecken des Behälters ist, dass sichergestellt werden soll, dass die Atmosphäre im Becherglas mit Lösungsmitteldampf gesättigt ist. Die Sättigung der Atmosphäre im Becherglas mit Dampf verhindert, dass das Lösungsmittel verdampft, wenn es auf dem Papier aufsteigt.
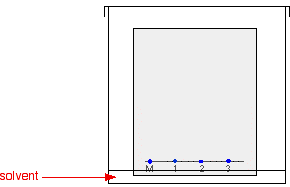
Während das Lösungsmittel langsam auf dem Papier nach oben wandert, wandern die verschiedenen Komponenten der Tintenmischungen mit unterschiedlichen Geschwindigkeiten und die Mischungen werden in verschiedenfarbige Flecken getrennt.
Das Diagramm zeigt, wie die Platte aussehen könnte, nachdem sich das Lösungsmittel fast bis nach oben bewegt hat.
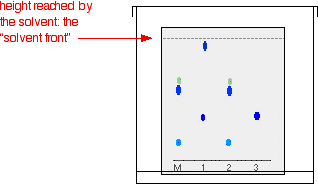
Aus dem endgültigen Chromatogramm ist ziemlich leicht zu erkennen, dass der Stift, der die Nachricht geschrieben hat, die gleichen Farbstoffe enthält wie Stift 2. Man kann auch sehen, dass Stift 1 eine Mischung aus zwei verschiedenen blauen Farbstoffen enthält – einer davon könnte derselbe sein wie der einzelne Farbstoff in Stift 3.
Rf-Werte
Einige Verbindungen in einer Mischung wandern fast so weit wie das Lösungsmittel, andere bleiben viel näher an der Basislinie. Die relativ zum Lösungsmittel zurückgelegte Strecke ist für eine bestimmte Verbindung eine Konstante, solange man alles andere konstant hält – zum Beispiel die Art des Papiers und die genaue Zusammensetzung des Lösungsmittels.
Die relativ zum Lösungsmittel zurückgelegte Strecke wird als Rf-Wert bezeichnet. Er kann für jede Verbindung mit der Formel berechnet werden:
![]()
Wenn z.B. eine Komponente eines Gemisches 9,6 cm von der Basislinie zurückgelegt hat, während das Lösungsmittel 12.0 cm, dann ist der Rf-Wert für diese Komponente:
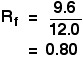
In dem Beispiel, das wir uns mit den verschiedenen Stiften angesehen haben, war es nicht notwendig, Rf-Werte zu messen, weil Sie einen direkten Vergleich nur durch das Betrachten des Chromatogramms machen.
Sie gehen davon aus, dass, wenn Sie zwei Flecken im endgültigen Chromatogramm haben, die die gleiche Farbe haben und den gleichen Weg auf dem Papier zurückgelegt haben, es sich höchstwahrscheinlich um die gleiche Verbindung handelt. Das ist natürlich nicht unbedingt wahr – Sie könnten zwei ähnlich gefärbte Verbindungen mit sehr ähnlichen Rf-Werten haben. Wir werden uns weiter unten auf der Seite ansehen, wie Sie dieses Problem umgehen können.
Was ist, wenn die Substanzen, an denen Sie interessiert sind, farblos sind?
In einigen Fällen kann es möglich sein, die Flecken sichtbar zu machen, indem man sie mit etwas reagieren lässt, das ein farbiges Produkt erzeugt. Ein gutes Beispiel dafür sind Chromatogramme von Aminosäuremischungen.
Angenommen, Sie haben eine Mischung von Aminosäuren und wollen herausfinden, welche Aminosäuren die Mischung genau enthält. Der Einfachheit halber nehmen wir an, dass Sie wissen, dass die Mischung nur fünf der üblichen Aminosäuren enthalten kann.
Ein kleiner Tropfen einer Lösung der Mischung wird auf die Grundlinie des Papiers gegeben, und ähnliche kleine Punkte der bekannten Aminosäuren werden daneben platziert. Das Papier wird dann in ein geeignetes Lösungsmittel gestellt und wie zuvor entwickelt. Im Diagramm ist die Mischung M, und die bekannten Aminosäuren sind mit 1 bis 5 beschriftet.
Die Position der Lösungsmittelfront wird mit Bleistift markiert und das Chromatogramm wird trocknen gelassen und dann mit einer Lösung von Ninhydrin besprüht. Ninhydrin reagiert mit Aminosäuren zu farbigen Verbindungen, hauptsächlich braun oder violett.
Das linke Diagramm zeigt das Papier, nachdem die Lösungsmittelfront fast oben angekommen ist. Die Flecken sind noch unsichtbar. Das zweite Diagramm zeigt, wie es nach dem Besprühen mit Ninhydrin aussehen könnte.
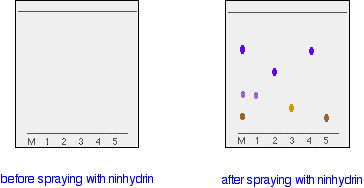
Es ist nicht nötig, die Rf-Werte zu messen, weil man die Flecken in der Mischung leicht mit denen der bekannten Aminosäuren vergleichen kann – sowohl von der Position als auch von der Farbe her.
In diesem Beispiel enthält die Mischung die Aminosäuren mit den Bezeichnungen 1, 4 und 5.
Und was wäre, wenn die Mischung andere Aminosäuren enthielte als die, die wir zum Vergleich herangezogen haben? Dann gäbe es Flecken in der Mischung, die nicht mit denen der bekannten Aminosäuren übereinstimmen. Man müsste das Experiment mit anderen Aminosäuren zum Vergleich wiederholen.
Die Zweiweg-Papierchromatographie
Die Zweiweg-Papierchromatographie umgeht das Problem der Trennung von Substanzen, die sehr ähnliche Rf-Werte haben.
Ich werde jetzt wieder von farbigen Verbindungen sprechen, weil es viel einfacher ist zu sehen, was passiert. Man kann das durchaus auch mit farblosen Verbindungen machen – aber man muss ziemlich viel Phantasie bei der Erklärung der Vorgänge aufwenden!
Diesmal wird ein Chromatogramm ausgehend von einem einzelnen Punkt der Mischung erstellt, der an einem Ende der Basislinie platziert wird. Es wird wie zuvor in ein Lösungsmittel gestellt und so lange belassen, bis die Lösungsmittelfront nahe an die Oberseite des Papiers herankommt.
Im Diagramm ist die Position der Lösungsmittelfront vor dem Austrocknen des Papiers mit Bleistift markiert. Sie ist mit SF1 bezeichnet – die Lösungsmittelfront für das erste Lösungsmittel. Wir werden zwei verschiedene Lösungsmittel verwenden.
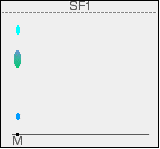
Wenn Sie genau hinsehen, können Sie vielleicht erkennen, dass der große zentrale Fleck im Chromatogramm teilweise blau und teilweise grün ist. Zwei Farbstoffe in der Mischung haben fast die gleichen Rf-Werte. Sie könnten natürlich auch beide die gleiche Farbe haben – in diesem Fall könnten Sie nicht sagen, ob ein oder mehrere Farbstoffe in diesem Fleck vorhanden sind.
Was Sie jetzt tun, ist zu warten, bis das Papier vollständig getrocknet ist, und es dann um 90° zu drehen und das Chromatogramm erneut in einem anderen Lösungsmittel zu entwickeln.
Es ist sehr unwahrscheinlich, dass die beiden verwirrenden Spots im zweiten Lösungsmittel die gleichen Rf-Werte haben wie im ersten, und so werden sich die Spots um einen unterschiedlichen Betrag bewegen.
Das nächste Diagramm zeigt, was mit den verschiedenen Spots auf dem ursprünglichen Chromatogramm passieren könnte. Die Position der zweiten Lösungsmittelfront ist ebenfalls markiert.
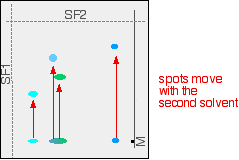
Natürlich würden Sie diese Spots nicht sowohl in ihrer ursprünglichen als auch in ihrer endgültigen Position sehen – sie haben sich bewegt! Das endgültige Chromatogramm würde so aussehen:
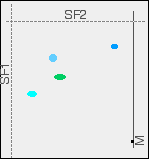
Die Zweiweg-Chromatographie hat das Gemisch vollständig in vier verschiedene Spots aufgeteilt.
Wenn Sie die Spots in der Mischung identifizieren wollen, können Sie das natürlich nicht mit Vergleichssubstanzen auf demselben Chromatogramm tun, wie wir es zuvor mit den Beispielen der Stifte oder Aminosäuren betrachtet haben. Sie können jedoch die Rf-Werte für jeden der Spots in beiden Lösungsmitteln ausrechnen und diese dann mit Werten vergleichen, die Sie für bekannte Verbindungen unter genau den gleichen Bedingungen gemessen haben.
Wie funktioniert die Papierchromatographie?
Obwohl die Papierchromatographie einfach durchzuführen ist, ist sie im Vergleich zur Dünnschichtchromatographie recht schwierig zu erklären. Die Erklärung hängt bis zu einem gewissen Grad davon ab, welche Art von Lösungsmittel Sie verwenden, und viele Quellen beschönigen das Problem vollständig. Falls Sie es noch nicht getan haben, wäre es hilfreich, wenn Sie die Erklärung zur Funktionsweise der Dünnschichtchromatographie lesen könnten (Link unten). Das erspart mir eine Menge Wiederholungen, und ich kann mich auf die Probleme konzentrieren.