Cristallisation
La cristallisation est une technique que les chimistes utilisent pour purifier les composés solides. C’est l’une des procédures fondamentales que chaque chimiste doit maîtriser pour devenir compétent en laboratoire. La cristallisation repose sur les principes de la solubilité : les composés (solutés) ont tendance à être plus solubles dans les liquides chauds (solvants) que dans les liquides froids. Si on laisse refroidir une solution chaude saturée, le soluté n’est plus soluble dans le solvant et forme des cristaux de composé pur. Les impuretés sont exclues des cristaux en croissance et les cristaux solides purs peuvent être séparés des impuretés dissoutes par filtration.
Cette description scientifique simplifiée de la cristallisation ne donne pas une image réaliste de la façon dont le processus est accompli en laboratoire. La réussite de la cristallisation repose plutôt sur un mélange de science et d’art ; son succès dépend davantage de l’expérimentation, de l’observation, de l’imagination et de l’habileté que des prédictions mathématiques et physiques. La compréhension du processus de cristallisation en soi ne fera pas d’un étudiant un maître cristallisateur ; cette compréhension doit être combinée à la pratique en laboratoire pour acquérir la maîtrise de cette technique.
Que se passe-t-il pendant une cristallisation
Pour cristalliser un composé solide impur, il faut lui ajouter juste assez de solvant chaud pour le dissoudre complètement. Le ballon contient alors une solution chaude, dans laquelle les molécules de soluté – à la fois le composé souhaité et les impuretés – se déplacent librement parmi les molécules de solvant chaud. Lorsque la solution refroidit, le solvant ne peut plus retenir toutes les molécules de soluté, et celles-ci commencent à quitter la solution et à former des cristaux solides. Pendant ce refroidissement, chaque molécule de soluté s’approche à son tour d’un cristal en croissance et se pose sur la surface du cristal. Si la géométrie de la molécule correspond à celle du cristal, elle aura plus de chances de rester sur le cristal que de retourner dans la solution. Par conséquent, chaque cristal en croissance est constitué d’un seul type de molécule, le soluté. Une fois que la solution a atteint la température ambiante, elle est soigneusement placée dans un bain de glace pour achever le processus de cristallisation. La solution refroidie est ensuite filtrée pour isoler les cristaux purs et les cristaux sont rincés avec du solvant refroidi.
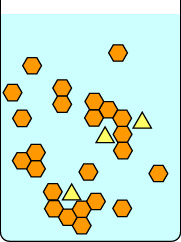
Cette première série de diagrammes montre ce qui se passe si on laisse une cristallisation se dérouler lentement : d’abord en plaçant le flacon à température ambiante sans le perturber jusqu’à la formation des cristaux, puis avec précaution sur de la glace. La barre rouge à droite de chaque image est un thermomètre, pour indiquer la température. Les triangles jaunes sont une impureté dans la solution chaude des hexagones orange. Si on laisse la solution refroidir lentement, les impuretés peuvent s’attacher brièvement au réseau cristallin en croissance, mais elles s’en vont rapidement car un composé à la géométrie plus appropriée vient prendre leur place. Les hexagones convenables restent plus facilement dans le réseau en croissance, et finalement des cristaux purs d’hexagones orange sont formés.
  |
  |
 |
.  |
  . . |
|||
1 |
2 |
3 |
4 |
||||
  . . |
Division  |
||||||
5 |
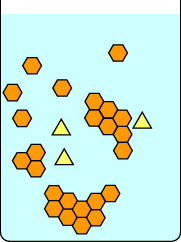
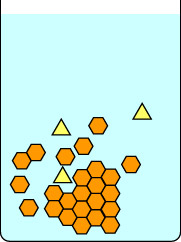
Cette deuxième série de diagrammes montre ce qui se passe si on refroidit la solution trop rapidement. Les impuretés du triangle jaune sont piégées à l’intérieur des cristaux en cours de formation par les hexagones orange, ainsi, les cristaux isolés sont impurs. Notez que la cristallisation lente donne des cristaux plus grands que la cristallisation rapide. Les petits cristaux ont un rapport surface/volume important et les impuretés sont situées à la surface des cristaux ainsi que piégées à l’intérieur de la matrice.
  |
  |
  |
  . . |
|||
1 |
2 |
4 |
Comment . To Do a Crystallization
 |
Chauffez un peu de solvant jusqu’à ébullition (pensez à utiliser une puce d’ébullition). Placez le solide à recristalliser dans un flacon Erlenmeyer. |
 |
Verser une petite quantité du solvant chaud dans le flacon contenant le solide. |
 |
Tourner le ballon pour dissoudre le solide. |
 |
Placer le ballon sur le bain de vapeur pour maintenir la solution chaude. |
 |
Si le solide n’est toujours pas dissous, ajoutez une infime quantité de solvant et agitez à nouveau. |  |
Lorsque le solide est entièrement en solution, posez-le sur la paillasse. Ne le dérangez pas ! |
 |
Après un certain temps, des cristaux devraient apparaître dans le flacon. |
 |
Vous pouvez maintenant placer le flacon dans un bain de glace pour terminer le processus de cristallisation. |  |
Vous êtes maintenant prêt à filtrer la solution pour isoler les cristaux. Veuillez consulter la section sur la filtration sous vide. Retirez le papier filtre de l’entonnoir de Buchner lorsque vous avez terminé. |
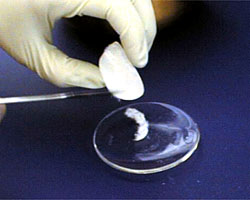 |
Après avoir filtré vos cristaux de la solution, mettez-les sur un verre de montre. |
 |
Laissez le cristal finir de sécher sur le verre de montre. |
Film sur la cristallisation
La chimie organique de l’UC a produit un film sur la cristallisation.
Quiz sur la technique de cristallisation
Voyez dans quelle mesure vous comprenez la cristallisation en répondant au questionnaire en ligne sur la technique de cristallisation!