Solubilità ed equilibri complesso-ione
Solubilità
Perché alcuni solidi si dissolvono in acqua?
Lo zucchero che usiamo per addolcire il caffè o il tè è un solido molecolare, in cui le singole molecole sono tenute insieme da forze intermolecolari relativamente deboli. Quando lo zucchero si scioglie in acqua, i deboli legami tra le singole molecole di saccarosio vengono rotti, e queste molecole C12H22O11 vengono rilasciate in soluzione.
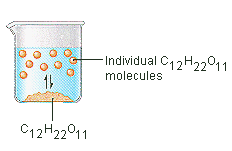
Ci vuole energia per rompere i legami tra le molecole C12H22O11 nel saccarosio. Ci vuole anche energia per rompere i legami idrogeno nell’acqua che deve essere interrotta per inserire una di queste molecole di saccarosio in soluzione. Lo zucchero si scioglie in acqua perché l’energia viene sprigionata quando le molecole di saccarosio leggermente polari formano legami intermolecolari con le molecole d’acqua polari. I deboli legami che si formano tra il soluto e il solvente compensano l’energia necessaria per distruggere la struttura del soluto puro e del solvente. Nel caso dello zucchero e dell’acqua, questo processo funziona così bene che fino a 1800 grammi di saccarosio possono dissolversi in un litro d’acqua.
I solidi ionici (o sali) contengono ioni positivi e negativi, che sono tenuti insieme dalla forte forza di attrazione tra particelle con carica opposta. Quando uno di questi solidi si dissolve in acqua, gli ioni che formano il solido vengono rilasciati in soluzione, dove si associano alle molecole polari del solvente.

| H2O | ||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) |
Si può generalmente assumere che i sali si dissocino nei loro ioni quando si dissolvono in acqua. I composti ionici si dissolvono in acqua se l’energia emessa quando gli ioni interagiscono con le molecole d’acqua compensa l’energia necessaria per rompere i legami ionici nel solido e l’energia richiesta per separare le molecole d’acqua in modo che gli ioni possano essere inseriti in soluzione.
![]()
Equilibri di solubilità
Le discussioni sugli equilibri di solubilità si basano sul seguente presupposto: Quando i solidi si dissolvono in acqua, si dissociano per dare le particelle elementari da cui sono formati. Così, i solidi molecolari si dissociano per dare singole molecole
| H2O | ||
| C12H22O11(s) | C12H22O11(aq) |
e i solidi ionici si dissociano per dare soluzioni degli ioni positivi e negativi che contengono.
| H2O | ||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) |
Quando il sale viene aggiunto per primo, si scioglie e si dissocia rapidamente. La conducibilità della soluzione aumenta quindi rapidamente all’inizio.
| dissolvere | ||||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) | |||
| dissociarsi |

Le concentrazioni di questi ioni diventano presto abbastanza grandi che la reazione inversa inizia a competere con quella in avanti, che porta ad una diminuzione della velocità con cui gli ioni Na+ e Cl- entrano nella soluzione.
| associati | ||||
| Na+(aq) | + | Cl-(aq) | NaCl(s) | |
| precipitato |
Eventualmente, le concentrazioni di ioni Na+ e Cl- diventano abbastanza grandi che il tasso di precipitazione equilibra esattamente il tasso di dissoluzione del NaC. Una volta che ciò accade, non vi è alcun cambiamento nella concentrazione di questi ioni con il tempo e la reazione è all’equilibrio. Quando questo sistema raggiunge l’equilibrio è chiamato una soluzione satura, perché contiene la massima concentrazione di ioni che può esistere in equilibrio con il sale solido. La quantità di sale che deve essere aggiunta a un dato volume di solvente per formare una soluzione satura è chiamata solubilità del sale.
![]()
Regole di solubilità
Ci sono una serie di modelli nei dati ottenuti dalla misurazione della solubilità di diversi sali. Questi schemi formano la base per le regole delineate nella tabella sottostante, che possono guidare le previsioni sul fatto che un dato sale si dissolva in acqua. Queste regole sono basate sulle seguenti definizioni dei termini solubile, insolubile e leggermente solubile.
- Un sale è solubile se si scioglie in acqua per dare una soluzione con una concentrazione di almeno 0,1 moli per litro a temperatura ambiente.
- Un sale è insolubile se la concentrazione di una soluzione acquosa è inferiore a 0,001 M a temperatura ambiente.
- Sali leggermente solubili danno soluzioni che cadono tra questi estremi.
Regole di solubilità per i composti ionici in acqua
Sale solubile
1. Gli ioni Na+, K+ e NH4+ formano sali solubili. Così, NaCl, KNO3, (NH4)2SO4, Na2S, e (NH4)2CO3 sono solubili.
2. Lo ione nitrato (NO3-) forma sali solubili. Così, Cu(NO3)2 e Fe(NO3)3 sono solubili.
3. Gli ioni cloruro (Cl-), bromuro (Br-), e ioduro (I-) generalmente formano sali solubili. Le eccezioni a questa regola includono i sali degli ioni Pb2+, Hg22+, Ag+ e Cu+. ZnCl2 è solubile, ma CuBr non lo è.
4. Lo ione solfato (SO42-) generalmente forma sali solubili. Le eccezioni includono BaSO4, SrSO4, e PbSO4, che sono insolubili, e Ag2SO4, CaSO4, e Hg2SO4, che sono leggermente solubili.
Sali insolubili
1. I solfuri (S2-) sono solitamente insolubili. Le eccezioni includono Na2S, K2S, (NH4)2S, MgS, CaS, SrS e BaS.
2. Gli ossidi (O2-) sono solitamente insolubili. Le eccezioni includono Na2O, K2O, SrO e BaO, che sono solubili, e CaO, che è leggermente solubile.
3. Gli idrossidi (OH-) sono solitamente insolubili. Le eccezioni includono NaOH, KOH, Sr(OH)2, e Ba(OH)2, che sono solubili, e Ca(OH)2, che è leggermente solubile.
4. I cromati (CrO42-) sono solitamente insolubili. Le eccezioni includono Na2CrO4, K2CrO4, (NH4)2CrO4, e MgCrO4.
5. I fosfati (PO43-) e i carbonati (CO32-) sono solitamente insolubili. Le eccezioni includono i sali degli ioni Na+, K+ e NH4+.
![]()