Oplosbaarheid en complex-Ion-evenwichten
Oplosbaarheid
Waarom lossen sommige vaste stoffen op in water?
De suiker die we gebruiken om koffie of thee te zoeten is een moleculaire vaste stof, waarin de afzonderlijke moleculen bij elkaar worden gehouden door relatief zwakke intermoleculaire krachten. Wanneer suiker in water oplost, worden de zwakke bindingen tussen de afzonderlijke sucrose-moleculen verbroken, en komen deze C12H22O11 moleculen vrij in oplossing.
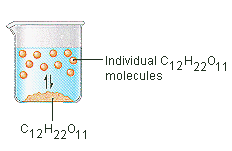
Er is energie nodig om de bindingen tussen de C12H22O11 moleculen in sucrose te verbreken. Er is ook energie nodig om de waterstofbruggen in water te verbreken die moeten worden verbroken om een van deze sucrosemoleculen in oplossing te brengen. Suiker lost op in water omdat er energie wordt afgegeven wanneer de licht polaire sucrose moleculen intermoleculaire bindingen vormen met de polaire watermoleculen. De zwakke bindingen die zich vormen tussen de vaste stof en het oplosmiddel compenseren de energie die nodig is om de structuur van zowel de zuivere stof als het oplosmiddel te verstoren. In het geval van suiker en water werkt dit proces zo goed dat tot 1800 gram sucrose kan oplossen in een liter water.
Ionische vaste stoffen (of zouten) bevatten positieve en negatieve ionen, die bij elkaar worden gehouden door de sterke aantrekkingskracht tussen deeltjes met tegengestelde ladingen. Wanneer een van deze vaste stoffen in water oplost, worden de ionen waaruit de vaste stof is opgebouwd, in oplossing gebracht, waar zij zich verbinden met de polaire moleculen van het oplosmiddel.

| H2O | ||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) |
We kunnen er in het algemeen van uitgaan dat zouten in hun ionen uiteenvallen als ze in water oplossen. Ionische verbindingen lossen op in water als de energie die vrijkomt bij de interactie van de ionen met de watermoleculen de energie compenseert die nodig is om de ionische bindingen in de vaste stof te verbreken en de energie die nodig is om de watermoleculen te scheiden, zodat de ionen in oplossing kunnen worden gebracht.
![]()
Oplosbaarheidsevenwichten
Discussies over oplosbaarheidsevenwichten zijn gebaseerd op de volgende veronderstelling: Wanneer vaste stoffen in water oplossen, splitsen zij en vormen de elementaire deeltjes waaruit zij zijn ontstaan. Dus, moleculaire vaste stoffen splitsen op tot afzonderlijke moleculen
| H2O | ||
| C12H22O11(aq) |
en ionische vaste stof dissocieert om oplossingen te geven van de positieve en negatieve ionen die ze bevatten.
| H2O | NaCl(s) | Na+(aq) | + | Cl-(aq) |
Wanneer het zout voor het eerst wordt toegevoegd, lost het op en ontleedt het snel. Het geleidingsvermogen van de oplossing neemt daarom in het begin snel toe.
| oplossen | NaCl(s) | Na+(aq) | + | Cl-(aq) | |
| dissociëren |

De concentraties van deze ionen worden al snel groot genoeg dat de omgekeerde reactie begint te concurreren met de voorwaartse reactie, wat leidt tot een afname van de snelheid waarmee Na+- en Cl-ionen in de oplossing terechtkomen.
| Na+(aq) | + | Cl-(aq) | NaCl(s) | |
Op den duur, worden de concentraties van de Na+- en Cl-ionen groot genoeg dat de snelheid waarmee neerslag optreedt precies gelijk is aan de snelheid waarmee NaCld oplost. Als dat gebeurd is, verandert de concentratie van deze ionen niet meer met de tijd en is de reactie in evenwicht. Wanneer dit systeem in evenwicht is, wordt het een verzadigde oplossing genoemd, omdat het de maximale concentratie ionen bevat die in evenwicht met het vaste zout kan bestaan. De hoeveelheid zout die aan een gegeven volume oplosmiddel moet worden toegevoegd om een verzadigde oplossing te vormen, wordt de oplosbaarheid van het zout genoemd.
![]()
Solubiliteitsregels
Er zijn een aantal patronen in de gegevens die worden verkregen door de oplosbaarheid van verschillende zouten te meten. Deze patronen vormen de basis voor de regels in onderstaande tabel, aan de hand waarvan kan worden voorspeld of een bepaald zout in water zal oplossen. Deze regels zijn gebaseerd op de volgende definities van de termen oplosbaar, onoplosbaar en slecht oplosbaar.
- Een zout is oplosbaar als het in water oplost tot een oplossing met een concentratie van ten minste 0,1 mol per liter bij kamertemperatuur.
- Een zout is onoplosbaar als de concentratie van een waterige oplossing bij kamertemperatuur minder dan 0,001 M bedraagt.
- Licht oplosbare zouten geven oplossingen die tussen deze uitersten in liggen.
Solubiliteitsregels voor Ionische verbindingen in water
Oplosbare zouten
1. De ionen Na+, K+ en NH4+ vormen oplosbare zouten. Zo zijn NaCl, KNO3, (NH4)2SO4, Na2S en (NH4)2CO3 oplosbaar.
2. Het nitraation (NO3-) vormt oplosbare zouten. Zo zijn Cu(NO3)2 en Fe(NO3)3 oplosbaar.
3. De ionen chloride (Cl-), bromide (Br-) en jodide (I-) vormen in het algemeen oplosbare zouten. Uitzonderingen op deze regel zijn de zouten van de ionen Pb2+, Hg22+, Ag+ en Cu+. ZnCl2 is oplosbaar, maar CuBr niet.
4. Het sulfaation (SO42-) vormt over het algemeen oplosbare zouten. Uitzonderingen zijn BaSO4, SrSO4 en PbSO4, die onoplosbaar zijn, en Ag2SO4, CaSO4 en Hg2SO4, die slecht oplosbaar zijn.
Oplosbare zouten
1. Sulfiden (S2-) zijn meestal onoplosbaar. Uitzonderingen zijn Na2S, K2S, (NH4)2S, MgS, CaS, SrS en BaS.
2. Oxiden (O2-) zijn meestal onoplosbaar. Uitzonderingen zijn Na2O, K2O, SrO en BaO, die oplosbaar zijn, en CaO, dat slecht oplosbaar is.
3. Hydroxiden (OH-) zijn gewoonlijk onoplosbaar. Uitzonderingen zijn NaOH, KOH, Sr(OH)2, en Ba(OH)2, die oplosbaar zijn, en Ca(OH)2, dat slecht oplosbaar is.
4. Chromaten (CrO42-) zijn gewoonlijk onoplosbaar. Uitzonderingen zijn Na2CrO4, K2CrO4, (NH4)2CrO4 en MgCrO4.
5. Fosfaten (PO43-) en carbonaten (CO32-) zijn gewoonlijk onoplosbaar. Uitzonderingen zijn zouten van de ionen Na+, K+, en NH4+.
![]()