Solubilidade e Equilíbrio de Íons Complexos
Solubilidade
Porquê Dissolver alguns Sólidos na Água?
O açúcar que usamos para adoçar café ou chá é um sólido molecular, no qual as moléculas individuais são mantidas juntas por forças intermoleculares relativamente fracas. Quando o açúcar se dissolve na água, as ligações fracas entre as moléculas individuais de sacarose são quebradas, e estas moléculas C12H22O11 são libertadas em intosolução.
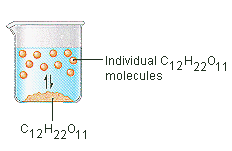
É necessária energia para quebrar as ligações entre as moléculas C12H22O11 em sacarose. Também é necessária energia para quebrar as ligações de hidrogénio na água que devem ser quebradas para inserir uma destas moléculas de sacarose na solução. O açúcar dissolve-se na água porque a energia é libertada quando as moléculas ligeiramente polares de sacarose formam ligações intermoleculares com as moléculas polares de água. As ligações fracas que se formam entre o soluto e o solvente compensam a energia necessária para perturbar a estrutura do soluto puro e do solvente. No caso do açúcar e da água, este processo funciona semeando que até 1800 gramas de sacarose podem dissolver-se num litro de água.
p>Sólidos iónicos (ou sais) contêm iões positivos e negativos, que são mantidos juntos pela forte força de atracção entre partículas com cargas opostas. Quando um destes sólidos se dissolve na água, os iões que formam o sólido são libertados em intosolução, onde se tornam associados às moléculas polares do solvente.

| H2O | ||
| Na+(aq) | Cl-(aq) |
Podemos geralmente assumir que os sais se dissociam nos seus iões quando se dissolvem na água. Os compostos iónicos dissolvem-se na água se a energia emitida quando os iões interagem com as moléculas de água compensar a energia necessária para quebrar as ligações iónicas no sólido e a energia necessária para separar as moléculas de água de modo a que os iões possam serinseridos em solução.
![]()
Solubilidade Equilibria
Discussões de equilíbrio de solubilidade baseiam-se na seguinte hipótese: Quando os sólidos se dissolvem na água, dissociam-se para dar as partículas elementares das quais se formam. Assim, os sólidos dissolvem-se na água, sólidos moleculares dissociados para dar moléculas individuais
| H2O | >/td> | |
| C12H22O11(aq) |
e os sólidos iónicos dissociam-se para dar soluções dos iões positivos e negativos teycontain.
| >/td>>>H2O | /td>>>>>/td>>>/td>>/td> | ||
| Na+(aq) | + | Cl-(aq) |
Quando o sal é adicionado pela primeira vez, dissolve-se e dissocia-se rapidamente. A condutividade da solução aumenta, portanto, rapidamente no início.
| >/td>>>dissolve | /td>>>>>/td>>>/td>>/td>>>/td>>>/tr> |
| Na+(aq) | + |

As concentrações destes iões rapidamente se tornam suficientemente grandes para que a reacção inversa comece a competir com a reacção dianteira, o que leva a uma diminuição da taxa a que os iões Na+ e Cl- entram na solução.
| /td> | associate | /td> | ||
| Na+(aq) | + | Cl-(aq) | NaCl(s) | |
Eventualmente, as concentrações de Na+ e Cl-ion tornam-se grandes – suficientemente grandes – para que a taxa a que ocorre a precipitação equilibre exactamente a taxa a que NaCldissolve. Quando isso acontece, não há alteração na concentração destes iões com o tempo e a reacção está em equilíbrio. Quando este sistema atinge o equilíbrio é uma solução saturada de calleda, porque contém a concentração máxima de iões que pode existir em equilíbrio com o sal sólido. A quantidade de sal que deve ser adicionada ao volume dado de solvente para formar uma solução saturada chama-se solubilidade do sal.
![]()
Regras de solubilidade
Existem vários padrões nos dados obtidos a partir da medição da solubilidade de sais diferentes. Estes padrões formam a base para as regras delineadas na tabela abaixo,que pode orientar as previsões sobre se um dado sal se dissolverá na água. Estas regras baseiam-se nas seguintes definições dos termos solúvel, insolúvel, e ligeiramente solúvel.
- Um sal é solúvel se se dissolver em água para dar uma solução com uma concentração de pelo menos 0,1 moles por litro à temperatura ambiente.
- Um sal é insolúvel se a concentração de uma solução aquosa for inferior a 0,001 M à temperatura ambiente.
- Sais ligeiramente solúveis dão soluções que caem entre estes extremos.
Regras de Solubilidade para Compostos Iónicos em Água
p>>br>>Sais Solúveisbr>>p>p>1. Os iões Na+, K+, e NH4+ formam sais solúveis. Assim, NaCl, KNO3, (NH4)2SO4, Na2S, e (NH4)2CO3 são solúveis.
>p>2. O ião nitrato (NO3-) forma sais solúveis. Assim, Cu(NO3)2 e Fe(NO3)3 são solúveis.3. Os iões cloreto (Cl-), brometo (Br-), e iodeto (I-) formam geralmente sais solúveis. As excepções a esta regra incluem os sais dos iões Pb2+, Hg22+, Ag+, e Cu+. ZnCl2 é solúvel, mas CuBr não é.
br>
4. O ião sulfato (SO42-) forma geralmente sais solúveis. As excepções incluem BaSO4, SrSO4, e PbSO4, que são insolúveis, e Ag2SO4, CaSO4, e Hg2SO4, que são ligeiramente solúveis.
br>>>p>>br>Sais insolúveisbr>>p>1. Os Sulfetos (S2-) são geralmente insolúveis. As excepções incluem Na2S, K2S, (NH4)2S, MgS, CaS, SrS, e BaS.>br>>
2. Os óxidos (O2-) são geralmente insolúveis. As excepções incluem Na2O, K2O, SrO, e BaO, que são solúveis, e CaO, que é ligeiramente solúvel.
3. Os hidróxidos (OH-) são geralmente insolúveis. As excepções incluem NaOH, KOH, Sr(OH)2, e Ba(OH)2, que são solúveis, e Ca(OH)2, que é ligeiramente solúvel.
4. Os cromatos (CrO42-) são geralmente insolúveis. As excepções incluem Na2CrO4, K2CrO4, (NH4)2CrO4, e MgCrO4.
5. Os fosfatos (PO43-) e carbonatos (CO32-) são geralmente insolúveis. As excepções incluem sais dos iões Na+, K+, e NH4+.