Spettroscopia di risonanza magnetica nucleare

Frequenza di risonanzaModifica
Quando sono posti in un campo magnetico, i nuclei attivi NMR (come 1H o 13C) assorbono la radiazione elettromagnetica ad una frequenza caratteristica dell’isotopo. La frequenza di risonanza, l’energia della radiazione assorbita e l’intensità del segnale sono proporzionali alla forza del campo magnetico. Per esempio, in un campo magnetico di 21 Tesla, i nuclei di idrogeno (comunemente chiamati protoni) risuonano a 900 MHz. È comune riferirsi a un magnete da 21 T come a un magnete da 900 MHz poiché l’idrogeno è il nucleo più comunemente rilevato, tuttavia nuclei diversi risuoneranno a frequenze diverse a questa intensità di campo in proporzione ai loro momenti magnetici nucleari.
Manipolazione del campioneModifica
Uno spettrometro NMR consiste tipicamente in un portacampione rotante all’interno di un magnete molto forte, un emettitore di radiofrequenza e un ricevitore con una sonda (un gruppo antenna) che va all’interno del magnete per circondare il campione, opzionalmente bobine di gradiente per misure di diffusione, ed elettronica per controllare il sistema. La rotazione del campione è solitamente necessaria per mediare il movimento diffusionale, tuttavia alcuni esperimenti richiedono un campione fermo quando il movimento della soluzione è una variabile importante. Per esempio, le misure delle costanti di diffusione (spettroscopia ordinata di diffusione o DOSY) sono fatte usando un campione stazionario con spinning off, e le celle di flusso possono essere usate per l’analisi online dei flussi di processo.
Solventi deuteratiModifica
La grande maggioranza delle molecole in una soluzione sono molecole di solvente, e la maggior parte dei solventi regolari sono idrocarburi e quindi contengono protoni NMR-attivi. Per evitare di rilevare solo segnali da atomi di idrogeno del solvente, vengono utilizzati solventi deuterati dove il 99+% dei protoni sono sostituiti con deuterio (idrogeno-2). Il solvente deuterato più usato è il deuterocloroformio (CDCl3), anche se altri solventi possono essere usati per varie ragioni, come la solubilità di un campione, il desiderio di controllare il legame a idrogeno o i punti di fusione o di ebollizione. Gli spostamenti chimici di una molecola cambieranno leggermente tra i solventi, e il solvente usato sarà quasi sempre riportato con gli spostamenti chimici. Gli spettri NMR sono spesso calibrati rispetto al picco protonico residuo del solvente noto, invece di aggiungere tetrametilsilano.
Shim e lockEdit
Per rilevare gli spostamenti di frequenza molto piccoli dovuti alla risonanza magnetica nucleare, il campo magnetico applicato deve essere costante in tutto il volume del campione. Gli spettrometri NMR ad alta risoluzione utilizzano spessori per regolare l’omogeneità del campo magnetico a parti per miliardo (ppb) in un volume di pochi centimetri cubici. Per rilevare e compensare la disomogeneità e la deriva del campo magnetico, lo spettrometro mantiene un “blocco” sulla frequenza del deuterio del solvente con un’unità di blocco separata, che è essenzialmente un trasmettitore supplementare e un processore RF sintonizzato sul nucleo di blocco (deuterio) piuttosto che sui nuclei del campione di interesse. Nei moderni spettrometri NMR lo shimming viene regolato automaticamente, anche se in alcuni casi l’operatore deve ottimizzare manualmente i parametri di shim per ottenere la migliore risoluzione possibile
Acquisizione di spettriModifica
Su eccitazione del campione con un impulso di radiofrequenza (60-1000 MHz), si ottiene una risposta di risonanza magnetica nucleare – un decadimento di induzione libera (FID). Si tratta di un segnale molto debole e richiede ricevitori radio sensibili per essere captato. Una trasformata di Fourier viene eseguita per estrarre lo spettro nel dominio della frequenza dal FID grezzo nel dominio del tempo. Uno spettro da un singolo FID ha un basso rapporto segnale-rumore, ma migliora facilmente con la media di acquisizioni ripetute. Buoni spettri 1H NMR possono essere acquisiti con 16 ripetizioni, il che richiede solo pochi minuti. Tuttavia, per gli elementi più pesanti dell’idrogeno, il tempo di rilassamento è piuttosto lungo, ad esempio circa 8 secondi per il 13C. Così, l’acquisizione di spettri quantitativi di elementi pesanti può richiedere molto tempo, da decine di minuti a ore.
Dopo l’impulso, i nuclei sono, in media, eccitati ad un certo angolo rispetto al campo magnetico dello spettrometro. L’estensione dell’eccitazione può essere controllata con la larghezza dell’impulso, tipicamente circa 3-8 µs per l’impulso ottimale a 90°. La larghezza dell’impulso può essere determinata tracciando l’intensità (firmata) in funzione della larghezza dell’impulso. Essa segue una curva sinusoidale e, di conseguenza, cambia segno alle larghezze d’impulso corrispondenti agli impulsi di 180° e 360°.
I tempi di decadimento dell’eccitazione, tipicamente misurati in secondi, dipendono dall’efficacia del rilassamento, che è più veloce per i nuclei più leggeri e nei solidi, e più lento per i nuclei più pesanti e nelle soluzioni, e possono essere molto lunghi nei gas. Se il secondo impulso di eccitazione viene inviato prematuramente prima che il rilassamento sia completo, il vettore di magnetizzazione medio non è decaduto allo stato di terra, il che influenza la forza del segnale in modo imprevedibile. In pratica, le aree dei picchi non sono quindi proporzionali alla stechiometria; solo la presenza, ma non la quantità di gruppi funzionali è possibile discernere. Un esperimento di recupero dell’inversione può essere fatto per determinare il tempo di rilassamento e quindi il ritardo richiesto tra gli impulsi. Viene trasmesso un impulso a 180°, un ritardo regolabile e un impulso a 90°. Quando l’impulso a 90° annulla esattamente il segnale, il ritardo corrisponde al tempo necessario per 90° di rilassamento. Il recupero dell’inversione è utile per il 13C quantitativo, il 2D e altri esperimenti che richiedono tempo.
Chemical shiftEdit
Una carica che gira genera un campo magnetico che risulta in un momento magnetico proporzionale allo spin. In presenza di un campo magnetico esterno, esistono due stati di spin (per un nucleo di spin 1/2): uno spin su e uno spin giù, dove uno si allinea con il campo magnetico e l’altro si oppone. La differenza di energia (ΔE) tra i due stati di spin aumenta all’aumentare della forza del campo, ma questa differenza è di solito molto piccola, il che porta alla necessità di magneti NMR forti (1-20 T per i moderni strumenti NMR). L’irradiazione del campione con l’energia corrispondente all’esatta separazione dello stato di spin di uno specifico gruppo di nuclei causerà l’eccitazione di quel gruppo di nuclei nello stato di energia inferiore allo stato di energia superiore.
Per i nuclei di spin 1/2, la differenza di energia tra i due stati di spin ad una data intensità di campo magnetico è proporzionale al loro momento magnetico. Tuttavia, anche se tutti i protoni hanno gli stessi momenti magnetici, non danno segnali risonanti agli stessi valori di frequenza. Questa differenza deriva dai diversi ambienti elettronici del nucleo di interesse. All’applicazione di un campo magnetico esterno, questi elettroni si muovono in risposta al campo e generano campi magnetici locali che si oppongono al campo applicato molto più forte. Questo campo locale “scherma” così il protone dal campo magnetico applicato, che deve quindi essere aumentato per ottenere la risonanza (assorbimento di energia rf). Tali incrementi sono molto piccoli, di solito in parti per milione (ppm). Per esempio, il picco del protone di un’aldeide è spostato di circa 10 ppm rispetto al picco di un idrocarburo, poiché, essendo un gruppo che sottrae elettroni, il carbonile deseleziona il protone riducendo la densità elettronica locale. La differenza tra 2,3487 T e 2,3488 T è quindi di circa 42 ppm. Tuttavia una scala di frequenza è comunemente usata per designare i segnali NMR, anche se lo spettrometro può funzionare spazzando il campo magnetico, e quindi i 42 ppm sono 4200 Hz per una frequenza di riferimento (rf) di 100 MHz.
Tuttavia, dato che la posizione dei diversi segnali NMR dipende dall’intensità del campo magnetico esterno e dalla frequenza di riferimento, i segnali sono solitamente riportati rispetto a un segnale di riferimento, solitamente quello del TMS (tetrametilsilano). Inoltre, poiché la distribuzione dei segnali NMR dipende dal campo, queste frequenze vengono divise per la frequenza dello spettrometro. Tuttavia, poiché stiamo dividendo Hz per MHz, il numero risultante sarebbe troppo piccolo, e quindi viene moltiplicato per un milione. Questa operazione dà quindi un numero localizzatore chiamato “chemical shift” con unità di parti per milione. In generale, gli spostamenti chimici per i protoni sono altamente prevedibili poiché gli spostamenti sono determinati principalmente da effetti di schermatura più semplici (densità di elettroni), ma gli spostamenti chimici per molti nuclei più pesanti sono più fortemente influenzati da altri fattori, compresi gli stati eccitati (contributo “paramagnetico” al tensore di schermatura).

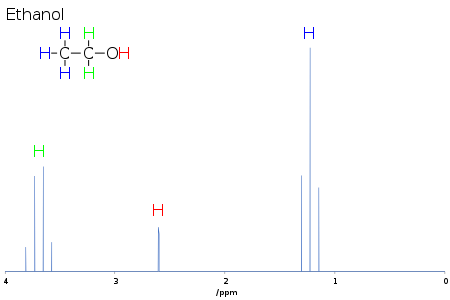
Lo spostamento chimico fornisce informazioni sulla struttura della molecola. La conversione dei dati grezzi in queste informazioni si chiama assegnazione dello spettro. Per esempio, per lo spettro 1H-NMR per l’etanolo (CH3CH2OH), ci si aspetterebbe segnali a ciascuno di tre specifici spostamenti chimici: uno per il gruppo CH3, uno per il gruppo CH2 e uno per il gruppo OH. Un tipico gruppo CH3 ha uno spostamento di circa 1 ppm, un CH2 attaccato a un OH ha uno spostamento di circa 4 ppm e un OH ha uno spostamento ovunque da 2-6 ppm a seconda del solvente usato e della quantità di legame a idrogeno. Mentre l’atomo di O distoglie la densità di elettroni dall’H attaccato attraverso il loro reciproco legame sigma, le coppie di elettroni solitari sull’O immergono l’H nel loro effetto schermante.
Nella spettroscopia NMR paramagnetica, le misure sono condotte su campioni paramagnetici. Il paramagnetismo dà origine a spostamenti chimici molto diversi. Nella spettroscopia NMR 1H, l’intervallo di spostamento chimico può arrivare fino a migliaia di ppm.
A causa del movimento molecolare a temperatura ambiente, i tre protoni metilici fanno media durante l’esperimento NMR (che richiede tipicamente alcuni ms). Questi protoni diventano degenerati e formano un picco allo stesso spostamento chimico.
Anche la forma e l’area dei picchi sono indicatori della struttura chimica. Nell’esempio precedente – lo spettro protonico dell’etanolo – il picco CH3 ha tre volte l’area del picco OH. Allo stesso modo il picco CH2 avrebbe il doppio dell’area del picco OH ma solo 2/3 dell’area del picco CH3.
Il software permette l’analisi dell’intensità del segnale dei picchi, che in condizioni di rilassamento ottimale, correlano con il numero di protoni di quel tipo. L’analisi dell’intensità del segnale si fa per integrazione – il processo matematico che calcola l’area sotto una curva. L’analista deve integrare il picco e non misurarne l’altezza perché i picchi hanno anche una larghezza e quindi la sua dimensione dipende dalla sua area e non dalla sua altezza. Tuttavia, va detto che il numero di protoni, o di qualsiasi altro nucleo osservato, è solo proporzionale all’intensità, o all’integrale, del segnale NMR negli esperimenti NMR unidimensionali più semplici. In esperimenti più elaborati, per esempio quelli tipicamente usati per ottenere gli spettri NMR del carbonio-13, l’integrale dei segnali dipende dalla velocità di rilassamento del nucleo e dalle sue costanti di accoppiamento scalare e dipolare. Molto spesso questi fattori sono poco conosciuti – quindi, l’integrale del segnale NMR è molto difficile da interpretare negli esperimenti NMR più complicati.
J-couplingEdit
| Moltiplicazione | Rapporto di intensità |
|---|---|
| Singlet (s) | 1 |
| Doublet (d) | 1:1 |
| Triplet (t) | 1:2:1 |
| Quartetto (q) | 1:3:3:1 |
| Quintetto | 1:4:6:4:1 |
| Sestetto | 1:5:10:10:5:1 |
| Septetto | 1:6:15:20:15:6:1 |
Alcune delle informazioni più utili per la determinazione della struttura in uno spettro NMR unidimensionale provengono dall’accoppiamento J o dall’accoppiamento scalare (un caso speciale di accoppiamento spin-spin) tra nuclei attivi NMR. Questo accoppiamento deriva dall’interazione di diversi stati di spin attraverso i legami chimici di una molecola e risulta nella scissione dei segnali NMR. Per un protone, il campo magnetico locale è leggermente diverso a seconda che un nucleo adiacente punti verso o contro il campo magnetico dello spettrometro, il che dà origine a due segnali per protone invece di uno. Questi schemi di scissione possono essere complessi o semplici e, allo stesso modo, possono essere direttamente interpretabili o ingannevoli. Questo accoppiamento fornisce una visione dettagliata della connettività degli atomi in una molecola.
L’accoppiamento a n nuclei equivalenti (spin ½) divide il segnale in un distinto n+1 con rapporti di intensità che seguono il triangolo di Pascal come descritto sulla destra. L’accoppiamento ad ulteriori spin porterà ad ulteriori sdoppiamenti di ogni componente del multipletto, ad esempio l’accoppiamento a due diversi nuclei di spin ½ con costanti di accoppiamento significativamente diverse porterà ad un doppietto di doppietti (abbreviazione: dd). Si noti che l’accoppiamento tra nuclei che sono chimicamente equivalenti (cioè, hanno lo stesso spostamento chimico) non ha alcun effetto sugli spettri NMR e gli accoppiamenti tra nuclei che sono distanti (di solito più di 3 legami a parte per i protoni in molecole flessibili) sono di solito troppo piccoli per causare splitting osservabili. Accoppiamenti a lungo raggio su più di tre legami possono spesso essere osservati in composti ciclici e aromatici, portando a modelli di scissione più complessi.
Per esempio, nello spettro protonico per l’etanolo descritto sopra, il gruppo CH3 è diviso in un tripletto con un rapporto di intensità di 1:2:1 dai due protoni CH2 vicini. Allo stesso modo, il CH2 è diviso in un quartetto con un rapporto di intensità di 1:3:3:1 dai tre protoni CH3 vicini. In linea di principio, i due protoni CH2 sarebbero anche divisi di nuovo in un doppietto per formare un doppietto di quartetti dal protone idrossile, ma lo scambio intermolecolare del protone idrossile acido spesso risulta in una perdita di informazioni di accoppiamento.
L’accoppiamento a qualsiasi nucleo di spin-1/2 come il fosforo-31 o il fluoro-19 funziona in questo modo (anche se le grandezze delle costanti di accoppiamento possono essere molto diverse). Ma i modelli di scissione differiscono da quelli descritti sopra per i nuclei con spin maggiore di ½ perché il numero quantico di spin ha più di due valori possibili. Per esempio, l’accoppiamento con il deuterio (un nucleo di spin 1) divide il segnale in una tripletta 1:1:1 perché lo spin 1 ha tre stati di spin. Allo stesso modo, un nucleo di spin 3/2 come il 35Cl divide il segnale in un quartetto 1:1:1:1 e così via.
L’accoppiamento combinato con lo spostamento chimico (e l’integrazione per i protoni) ci dice non solo l’ambiente chimico dei nuclei, ma anche il numero di nuclei NMR attivi vicini nella molecola. In spettri più complessi con picchi multipli a spostamenti chimici simili o in spettri di nuclei diversi dall’idrogeno, l’accoppiamento è spesso l’unico modo per distinguere nuclei diversi.

Accoppiamento di secondo ordine (o forte)
La descrizione precedente presuppone che la costante di accoppiamento sia piccola rispetto alla differenza di frequenze NMR tra gli spin ineguali. Se la separazione di spostamento diminuisce (o la forza di accoppiamento aumenta), i modelli di intensità dei multipletti vengono prima distorti, e poi diventano più complessi e meno facilmente analizzabili (specialmente se sono coinvolte più di due spine). L’intensificazione di alcuni picchi in un multipletto si ottiene a spese dei rimanenti, che a volte quasi scompaiono nel rumore di fondo, anche se l’area integrata sotto i picchi rimane costante.Nella maggior parte delle NMR ad alto campo, tuttavia, le distorsioni sono solitamente modeste e le distorsioni caratteristiche (copertura) possono infatti aiutare a identificare i picchi correlati.
Alcuni di questi modelli possono essere analizzati con il metodo pubblicato da John Pople, anche se ha una portata limitata.
Gli effetti di secondo ordine diminuiscono con l’aumentare della differenza di frequenza tra i multipli, così che gli spettri NMR ad alto campo (cioè ad alta frequenza) mostrano meno distorsioni degli spettri a bassa frequenza. I primi spettri a 60 MHz erano più inclini alla distorsione rispetto agli spettri provenienti da macchine successive che operano tipicamente a frequenze di 200 MHz o superiori.
Inoltre, come nella figura a destra, l’accoppiamento J può essere usato per identificare la sostituzione orto-meta-para di un anello. L’accoppiamento orto è il più forte a 15 Hz, Meta segue con una media di 2 Hz, e infine l’accoppiamento para è solitamente insignificante per gli studi.
Magnetic inequivalenceEdit
Effetti più sottili possono verificarsi se spin chimicamente equivalenti (cioè, nuclei legati da simmetria e quindi aventi la stessa frequenza NMR) hanno diverse relazioni di accoppiamento con spin esterni. Spins che sono chimicamente equivalenti, ma non sono indistinguibili (sulla base delle loro relazioni di accoppiamento) sono chiamati magneticamente inequivalenti.Per esempio, i siti 4 H di 1,2-diclorobenzene dividere in due coppie chimicamente equivalenti per simmetria, ma un singolo membro di una delle coppie ha diversi accoppiamenti alle spine che compongono l’altra coppia.inequivalenza magnetica può portare a spettri molto complessi che possono essere analizzati solo da modellazione computazionale. Tali effetti sono più comuni negli spettri NMR degli aromatici e di altri sistemi non flessibili, mentre la media conformazionale sui legami C-C nelle molecole flessibili tende a livellare gli accoppiamenti tra i protoni sui carboni adiacenti, riducendo i problemi di disuguaglianza magnetica.