Nucleaire magnetische resonantiespectroscopie

ResonantiefrequentieEdit
Wanneer NMR-actieve kernen (zoals 1H of 13C) in een magnetisch veld worden geplaatst, absorberen zij elektromagnetische straling met een frequentie die kenmerkend is voor de isotoop. De resonantiefrequentie, de energie van de geabsorbeerde straling, en de intensiteit van het signaal zijn evenredig met de sterkte van het magnetische veld. In een magneetveld van 21 Tesla bijvoorbeeld resoneren waterstofkernen (gewoonlijk protonen genoemd) bij 900 MHz. Een 21 T-magneet wordt gewoonlijk een 900 MHz-magneet genoemd omdat waterstof de meest gedetecteerde kern is, maar verschillende kernen zullen bij deze veldsterkte met verschillende frequenties resoneren, naar evenredigheid van hun kernmagnetische momenten.
Behandeling van het monster
Een NMR-spectrometer bestaat gewoonlijk uit een ronddraaiende monsterhouder in een zeer sterke magneet, een radiofrequentiezender en een ontvanger met een sonde (een antenne-assemblage) die in de magneet gaat en het monster omgeeft, optioneel gradiëntspoelen voor diffusiemetingen, en elektronica om het systeem te regelen. Het draaien van het monster is meestal noodzakelijk om de diffusiebeweging uit te middelen, maar sommige experimenten vereisen een stilstaand monster wanneer de beweging van de oplossing een belangrijke variabele is. Zo worden metingen van diffusieconstanten (diffusie geordende spectroscopie of DOSY) gedaan met een stationair monster waarbij het centrifugeren is uitgeschakeld, en kunnen flowcellen worden gebruikt voor online analyse van processtromen.
Gedeutereerde oplosmiddelen
De overgrote meerderheid van moleculen in een oplossing zijn oplosmoleculen, en de meeste gewone oplosmiddelen zijn koolwaterstoffen en bevatten dus NMR-actieve protonen. Om te voorkomen dat alleen signalen van waterstofatomen in het oplosmiddel worden gedetecteerd, worden geuterateerde oplosmiddelen gebruikt waarin 99+% van de protonen is vervangen door deuterium (waterstof-2). Het meest gebruikte geduterateerde oplosmiddel is deuterochloroform (CDCl3), hoewel ook andere oplosmiddelen kunnen worden gebruikt om uiteenlopende redenen, zoals de oplosbaarheid van een monster, de wens om de waterstofbruggen te controleren, of het smelt- of kookpunt. De chemische verschuivingen van een molecule zullen tussen de oplosmiddelen enigszins veranderen, en het gebruikte oplosmiddel zal bijna altijd met chemische verschuivingen worden gerapporteerd. NMR-spectra worden vaak gekalibreerd tegen de bekende restprotonpiek van het oplosmiddel in plaats van toegevoegd tetramethylsilaan.
Shim en lockEdit
Om de zeer kleine frequentieverschuivingen als gevolg van kernspinresonantie te detecteren, moet het toegepaste magnetische veld constant zijn in het gehele monstervolume. NMR spectrometers met hoge resolutie gebruiken shims om de homogeniteit van het magnetisch veld aan te passen aan delen per miljard (ppb) in een volume van enkele kubieke centimeters. Om inhomogeniteit en drift in het magnetisch veld te detecteren en te compenseren, handhaaft de spectrometer een “lock” op de deuteriumfrequentie van het oplosmiddel met een afzonderlijke lock unit, die in wezen een extra zender en RF-processor is die is afgestemd op de lock-kern (deuterium) in plaats van de kernen van het monster van belang. In moderne NMR spectrometers wordt shimming automatisch aangepast, hoewel in sommige gevallen de operator de shim-parameters handmatig moet optimaliseren om de best mogelijke resolutie te verkrijgen
Acquisitie van spectraEdit
Bij excitatie van het monster met een radiofrequente (60-1000 MHz) puls wordt een kernspinresonantierespons – een vrij inductieverval (FID) – verkregen. Dit is een zeer zwak signaal, dat alleen door gevoelige radio-ontvangers kan worden opgepikt. Een Fourier-transformatie wordt uitgevoerd om het frequentiespectrum te extraheren uit de ruwe tijdsdomein-FID. Een spectrum van een enkele FID heeft een lage signaal-ruisverhouding, maar deze verbetert snel door middeling van herhaalde acquisities. Goede 1H NMR-spectra kunnen worden verkregen met 16 herhalingen, wat slechts enkele minuten duurt. Voor elementen zwaarder dan waterstof is de relaxatietijd echter vrij lang, bv. ongeveer 8 seconden voor 13C. De verwerving van kwantitatieve spectra van zware elementen kan dus tijdrovend zijn en tientallen minuten tot uren in beslag nemen.
Na de puls worden de kernen gemiddeld geëxciteerd tot een bepaalde hoek ten opzichte van het magnetische veld van de spectrometer. De mate van excitatie kan worden geregeld met de pulsbreedte, meestal ca. 3-8 µs voor de optimale 90 ° puls. De pulsbreedte kan worden bepaald door de (getekende) intensiteit uit te zetten als functie van de pulsbreedte. Deze volgt een sinuscurve en verandert dienovereenkomstig van teken bij pulsbreedten die overeenkomen met 180° en 360° pulsen.
De vervaltijd van de excitatie, gewoonlijk gemeten in seconden, hangt af van de effectiviteit van de relaxatie, die sneller is voor lichtere kernen en in vaste stoffen, en langzamer voor zwaardere kernen en in oplossingen, en in gassen kan deze zeer lang zijn. Indien de tweede excitatiepuls te vroeg wordt uitgezonden voordat de relaxatie is voltooid, is de gemiddelde magnetiseringsvector nog niet gedaald tot de grondtoestand, hetgeen de sterkte van het signaal op onvoorspelbare wijze beïnvloedt. In de praktijk zijn de piekoppervlakken dan niet evenredig met de stoichiometrie; alleen de aanwezigheid, maar niet de hoeveelheid functionele groepen kan worden onderscheiden. Een inversie-terugwinningsexperiment kan worden uitgevoerd om de relaxatietijd en dus de vereiste vertraging tussen pulsen te bepalen. Een 180° puls, een instelbare vertraging, en een 90° puls worden uitgezonden. Wanneer de puls van 90° het signaal precies opheft, komt de vertraging overeen met de tijd die nodig is voor een relaxatie van 90°. Inversieherstel is de moeite waard voor kwantitatieve 13C, 2D en andere tijdrovende experimenten.
Chemische verschuivingEdit
Een spinnende lading wekt een magnetisch veld op dat resulteert in een magnetisch moment dat evenredig is met de spin. In aanwezigheid van een extern magnetisch veld bestaan er twee spin-toestanden (voor een kern met spin 1/2): een spin omhoog en een spin omlaag, waarbij de ene op één lijn ligt met het magnetisch veld en de andere ertegenin. Het verschil in energie (ΔE) tussen de twee spin toestanden neemt toe naarmate de sterkte van het veld toeneemt, maar dit verschil is meestal zeer klein, hetgeen leidt tot de eis voor sterke NMR magneten (1-20 T voor moderne NMR instrumenten). Bestraling van het monster met energie die overeenkomt met de exacte scheiding van de spintoestand van een specifieke set kernen zal excitatie van die set kernen in de lagere energietoestand tot de hogere energietoestand veroorzaken.
Voor spin 1/2-kernen is het energieverschil tussen de twee spintoestanden bij een gegeven magnetische veldsterkte evenredig met hun magnetisch moment. Maar zelfs als alle protonen dezelfde magnetische momenten hebben, geven zij geen resonantiesignalen bij dezelfde frequentiewaarden. Dit verschil vloeit voort uit de verschillende elektronische omgevingen van de betrokken kern. Wanneer een extern magnetisch veld wordt toegepast, bewegen deze elektronen in reactie op het veld en genereren zij lokale magnetische velden die het veel sterkere toegepaste veld tegenwerken. Dit lokale veld “schermt” het proton dus af van het toegepaste magnetische veld, dat dus moet worden verhoogd om resonantie (absorptie van rf-energie) te bereiken. Dergelijke verhogingen zijn zeer klein, gewoonlijk in deeltjes per miljoen (ppm). Zo wordt de protonpiek van een aldehyde ongeveer 10 ppm verschoven ten opzichte van een koolwaterstofpiek, omdat de carbonyl als elektrononttrekkende groep het proton afschermt door de plaatselijke elektronendichtheid te verminderen. Het verschil tussen 2,3487 T en 2,3488 T is dus ongeveer 42 ppm. Er wordt echter gewoonlijk een frequentieschaal gebruikt om de NMR-signalen aan te duiden, hoewel de spectrometer kan werken door het magnetisch veld te sweepen, en de 42 ppm is dus 4200 Hz voor een referentiefrequentie (rf) van 100 MHz.
Gezien echter het feit dat de plaats van de verschillende NMR-signalen afhankelijk is van de externe magnetische veldsterkte en de referentiefrequentie, worden de signalen gewoonlijk gerapporteerd ten opzichte van een referentiesignaal, meestal dat van TMS (tetramethylsilaan). Bovendien, aangezien de verdeling van NMR signalen veldafhankelijk is, worden deze frequenties gedeeld door de spectrometer frequentie. Aangezien we Hz door MHz delen, zou het resulterende getal echter te klein zijn, en wordt het dus met een miljoen vermenigvuldigd. Deze bewerking geeft dus een lokalisatiegetal, de “chemische verschuiving” genoemd, met eenheden van deeltjes per miljoen. In het algemeen zijn chemische verschuivingen voor protonen zeer voorspelbaar, aangezien de verschuivingen hoofdzakelijk worden bepaald door eenvoudiger afschermende effecten (elektronendichtheid), maar de chemische verschuivingen voor veel zwaardere kernen worden sterker beïnvloed door andere factoren, waaronder aangeslagen toestanden (“paramagnetische” bijdrage aan de afschermende tensor).

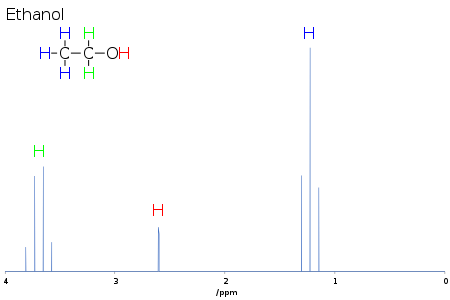
De chemische verschuiving geeft informatie over de structuur van het molecuul. De omzetting van de ruwe gegevens in deze informatie wordt het toewijzen van het spectrum genoemd. Bijvoorbeeld, voor het 1H-NMR spectrum voor ethanol (CH3CH2OH) zou men signalen verwachten bij elk van drie specifieke chemische verschuivingen: één voor de CH3 groep, één voor de CH2 groep en één voor de OH groep. Een typische CH3 groep heeft een verschuiving rond 1 ppm, een CH2 gekoppeld aan een OH heeft een verschuiving van ongeveer 4 ppm en een OH heeft een verschuiving ergens tussen 2-6 ppm, afhankelijk van het gebruikte oplosmiddel en de hoeveelheid waterstofbinding. Terwijl het O-atoom elektronendichtheid wegtrekt van de aanhangende H door hun wederzijdse sigma binding, baden de elektronen lone paren op de O de H in hun afschermingseffect.
In paramagnetische NMR spectroscopie, worden metingen uitgevoerd op paramagnetische monsters. Het paramagnetisme geeft aanleiding tot zeer uiteenlopende chemische verschuivingen. Bij 1H NMR spectroscopie kan het bereik van de chemische verschuiving duizenden ppm bedragen.
Omdat de moleculen bij kamertemperatuur bewegen, worden de drie methylprotonen tijdens het NMR-experiment (dat meestal een paar ms duurt) uitgemiddeld. Deze protonen worden gedegenereerd en vormen een piek met dezelfde chemische verschuiving.
De vorm en het gebied van de pieken zijn ook indicatoren van de chemische structuur. In het bovenstaande voorbeeld – het protonenspectrum van ethanol – is de CH3-piek drie keer zo groot als de OH-piek. Evenzo zou de CH2-piek tweemaal de oppervlakte van de OH-piek hebben, maar slechts 2/3 van de oppervlakte van de CH3-piek.
Software maakt analyse van de signaalintensiteit van pieken mogelijk, die onder voorwaarden van optimale relaxatie correleren met het aantal protonen van dat type. De analyse van de signaalintensiteit geschiedt door integratie – een wiskundig proces dat de oppervlakte onder een curve berekent. De analist moet de piek integreren en niet zijn hoogte meten, omdat de pieken ook breedte hebben en de grootte dus afhangt van zijn oppervlakte en niet van zijn hoogte. Er zij echter op gewezen dat het aantal protonen, of enige andere waargenomen kern, alleen evenredig is met de intensiteit, of de integraal, van het NMR-signaal in de allereenvoudigste eendimensionale NMR-experimenten. In meer uitgebreide experimenten, bijvoorbeeld experimenten die typisch worden gebruikt om koolstof-13 NMR spectra te verkrijgen, hangt de integraal van de signalen af van de relaxatiesnelheid van de kern, en zijn scalaire en dipolaire koppelingsconstanten. Heel vaak zijn deze factoren slecht bekend – daarom is de integraal van het NMR signaal zeer moeilijk te interpreteren in meer gecompliceerde NMR experimenten.
J-koppelingEdit
| Multipliciteit | Intensiteitsverhouding |
|---|---|
| Singlet (s) | 1 |
| Doublet (d) | 1:1 |
| 1:2:1 | |
| Quartet (q) | 1:3:3:1 |
| Quintet | 1:4:6:4:1 |
| Sextet | 1:5:10:10:5:1 |
| Septet | 1:6:15:20:15:6:1 |
Enkele van de nuttigste informatie voor structuurbepaling in een eendimensionaal NMR spectrum komt van J-koppeling of scalaire koppeling (een speciaal geval van spin-spin koppeling) tussen NMR actieve kernen. Deze koppeling ontstaat door de interactie van verschillende spintoestanden via de chemische bindingen van een molecuul en resulteert in de splitsing van NMR signalen. Voor een proton is het lokale magnetische veld enigszins verschillend naargelang een aangrenzende kern naar het magnetische veld van de spectrometer toe of ertegenin wijst, hetgeen aanleiding geeft tot twee signalen per proton in plaats van één. Deze splitsingspatronen kunnen complex of eenvoudig zijn en kunnen evenzo eenvoudig interpreteerbaar of bedrieglijk zijn. Deze koppeling geeft een gedetailleerd inzicht in de connectiviteit van atomen in een molecuul.
Koppeling aan n equivalente (spin ½) kernen splitst het signaal in een n+1 multiplet met intensiteitsverhoudingen volgens de driehoek van Pascal zoals hiernaast beschreven. Koppeling aan extra spins leidt tot verdere splitsingen van elke component van het multiplet, bv. koppeling aan twee verschillende spin ½ kernen met significant verschillende koppelconstanten leidt tot een doublet van doubletten (afkorting: dd). Merk op dat koppeling tussen kernen die chemisch equivalent zijn (d.w.z. dezelfde chemische verschuiving hebben) geen effect heeft op de NMR-spectra en dat koppelingen tussen kernen die ver van elkaar verwijderd zijn (gewoonlijk meer dan 3 bindingen van elkaar voor protonen in flexibele moleculen) gewoonlijk te klein zijn om waarneembare splitsingen te veroorzaken. Lange-afstand koppelingen over meer dan drie bindingen kunnen vaak worden waargenomen in cyclische en aromatische verbindingen, wat leidt tot meer complexe splitsingspatronen.
Bij voorbeeld, in het proton spectrum voor ethanol dat hierboven is beschreven, wordt de CH3 groep gesplitst in een triplet met een intensiteit verhouding van 1:2:1 door de twee naburige CH2 protonen. Evenzo wordt de CH2-groep gesplitst in een kwartet met een intensiteitsverhouding van 1:3:3:1 door de drie naburige CH3-protonen. In principe zouden de twee CH2-protonen ook weer in een doublet worden gesplitst om een doublet van kwartetten te vormen door het hydroxylproton, maar intermoleculaire uitwisseling van het zure hydroxylproton resulteert vaak in een verlies van koppelingsinformatie.
Koppeling aan elke spin-1/2 kern zoals fosfor-31 of fluor-19 werkt op deze manier (hoewel de magnitudes van de koppelingsconstanten zeer verschillend kunnen zijn). Maar de splijtingspatronen verschillen van die welke hierboven zijn beschreven voor kernen met een spin groter dan ½ omdat het spin-kwantumgetal meer dan twee mogelijke waarden heeft. Koppeling aan deuterium (een spin 1-kern) splitst het signaal bijvoorbeeld in een 1:1:1 triplet omdat de spin 1 drie spin-toestanden heeft. Op dezelfde manier splitst een spin 3/2 kern zoals 35Cl een signaal in een 1:1:1:1 kwartet, enzovoort.
Koppeling in combinatie met de chemische verschuiving (en de integratie voor protonen) vertelt ons niet alleen iets over de chemische omgeving van de kernen, maar ook over het aantal naburige actieve NMR-kernen binnen het molecuul. In complexere spectra met meerdere pieken bij vergelijkbare chemische verschuivingen of in spectra van andere kernen dan waterstof, is koppeling vaak de enige manier om verschillende kernen te onderscheiden.

Tweede-orde (of sterke) koppelingEdit
In bovenstaande beschrijving wordt aangenomen dat de koppelingsconstante klein is in vergelijking met het verschil in NMR-frequenties tussen de inequivalente spins. Als de verschuivingsafstand afneemt (of de koppelingssterkte toeneemt), worden de multiplet-intensiteitspatronen eerst vervormd, en vervolgens complexer en minder gemakkelijk te analyseren (vooral als er meer dan twee spins bij betrokken zijn). Intensivering van sommige pieken in een multiplet gaat ten koste van de rest, die soms bijna in de achtergrondruis verdwijnen, hoewel het geïntegreerde gebied onder de pieken constant blijft.In de meeste hoog-veld NMR zijn de vervormingen echter meestal bescheiden en de karakteristieke vervormingen (overkappingen) kunnen in feite helpen om verwante pieken te identificeren.
Enkele van deze patronen kunnen worden geanalyseerd met de door John Pople gepubliceerde methode, hoewel deze een beperkt toepassingsgebied heeft.
Tweede-orde effecten nemen af naarmate het frequentieverschil tussen multiplets toeneemt, zodat hoog-veld (d.w.z. hoge-frequentie) NMR spectra minder vervorming vertonen dan lagere frequentie spectra. Vroege spectra op 60 MHz waren gevoeliger voor vervorming dan spectra van latere machines die typisch werken op frequenties van 200 MHz of hoger.
Daarnaast kan, zoals in de figuur hiernaast, J-koppeling worden gebruikt om ortho-meta-para substitutie van een ring te identificeren. Ortho koppeling is het sterkst bij 15 Hz, Meta volgt met een gemiddelde van 2 Hz, en tenslotte is para koppeling meestal onbelangrijk voor studies.
Magnetische inequivalentieEdit
Er kunnen subtielere effecten optreden als chemisch equivalente spins (d.w.z. kernen die door symmetrie verwant zijn en dus dezelfde NMR-frequentie hebben) verschillende koppelingsrelaties hebben met externe spins. Spins die chemisch equivalent zijn maar niet te onderscheiden (op basis van hun koppelingsrelaties) worden magnetisch inequivalent genoemd. Bijvoorbeeld, de 4 H sites van 1,2-dichloorbenzeen verdelen zich door symmetrie in twee chemisch equivalente paren, maar een individueel lid van een van de paren heeft verschillende koppelingen met de spins die het andere paar vormen. Magnetische inequivalentie kan leiden tot zeer complexe spectra die alleen kunnen worden geanalyseerd door computationele modellering. Dergelijke effecten komen vaker voor in NMR spectra van aromatische en andere niet-flexibele systemen, terwijl conformatiegemiddelden over C-C bindingen in flexibele moleculen de neiging hebben om de koppelingen tussen protonen op aangrenzende koolstofatomen gelijk te maken, waardoor problemen met magnetische inequivalentie worden verminderd.