Dlaczego metale tak dobrze przewodzą ciepło i elektryczność? Jakie metale przewodzą najlepiej?
Struktura metali
Struktury czystych metali są proste do opisania, ponieważ atomy, które je tworzą, mogą być postrzegane jako identyczne doskonałe kule. Dokładniej mówiąc, struktura metaliczna składa się z „wyrównanych jonów dodatnich” (kationów) w „morzu” zdelokalizowanych elektronów. Oznacza to, że elektrony mogą swobodnie przemieszczać się w całej strukturze i przyczynia się do powstania właściwości takich jak przewodnictwo.
Jakie są różne rodzaje wiązań?
Wiązania kowalencyjne
Wiązanie kowalencyjne to wiązanie, które powstaje, gdy dwa atomy dzielą się elektronami. Przykłady związków z wiązaniami kowalencyjnymi to woda, cukier i dwutlenek węgla.
Wiązania jonowe
Wiązanie jonowe to całkowite przeniesienie elektronu(ów) walencyjnego(ych) pomiędzy metalem i niemetalem. W wyniku tego powstają dwa przeciwnie naładowane jony, które przyciągają się wzajemnie. W wiązaniach jonowych, metal traci elektrony, aby stać się dodatnio naładowanym kationem, podczas gdy niemetal przyjmuje te elektrony, aby stać się ujemnie naładowanym anionem. Przykładem wiązania jonowego może być sól (NaCl).
Wiązania metaliczne
Wiązanie metaliczne jest wynikiem elektrostatycznej siły przyciągającej, która występuje pomiędzy elektronami przewodnictwa (w postaci chmury elektronowej zdelokalizowanych elektronów) i dodatnio naładowanymi jonami metalu. Można je opisać jako dzielenie się elektronami swobodnymi pomiędzy siatką dodatnio naładowanych jonów (kationów). Wiązanie metaliczne odpowiada za wiele właściwości fizycznych metali, takich jak wytrzymałość, plastyczność, oporność termiczna i elektryczna oraz przewodność, nieprzezroczystość i połysk.
Zlokalizowane ruchome elektrony w metalach —
To swobodny ruch elektronów w metalach nadaje im przewodność.
Przewodnictwo elektryczne
Metale zawierają swobodnie poruszające się zdelokalizowane elektrony. Kiedy przyłożone jest napięcie elektryczne, pole elektryczne w metalu wyzwala ruch elektronów, sprawiając, że przesuwają się one z jednego końca na drugi koniec przewodnika. Elektrony będą poruszać się w kierunku strony dodatniej.
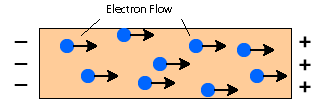
Przewodzenie ciepła
Metal dobrze przewodzi ciepło. Przewodzenie występuje, gdy substancja jest ogrzewana, cząsteczki zyskują więcej energii i bardziej wibrują. Cząsteczki te następnie wpadają na pobliskie cząsteczki i przekazują im część swojej energii. To następnie kontynuuje i przekazuje energię z gorącego końca w dół do zimniejszego końca substancji.
Dlaczego metale tak dobrze przewodzą ciepło?
Elektrony w metalach są zdelokalizowane i są elektronami swobodnie poruszającymi się, więc kiedy zyskują energię (ciepło), wibrują szybciej i mogą się poruszać, co oznacza, że mogą przekazywać energię szybciej.
Które metale najlepiej przewodzą prąd?
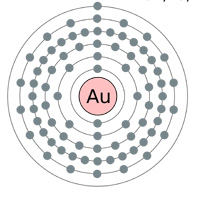
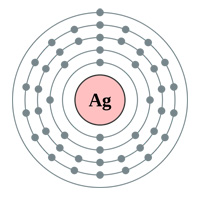
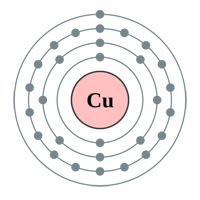
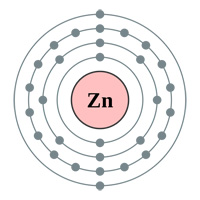
Powyżej: Powłoki elektronowe Złoto (au), Srebro (Ag), Miedź(Cu) i Cynk (Zn). Logika kazałaby myśleć, że złoto jest najlepszym przewodnikiem posiadającym pojedynczy elektron s-orbitalny w ostatniej powłoce (powyższy wykres) … więc dlaczego srebro i miedź są faktycznie lepsze (patrz tabela poniżej).
|
Przewodnictwo metali
|
>S/m
|
| Srebro | 6.30×10 7 |
| Miedź | 5.96×10 7 |
| Złoto | 4.10×10 7 |
| Aluminium | 3.50×10 7 |
| Cynk | 1.69×10 7 |
Srebro ma większy promień atomowy (160 pm) niż złoto (135 pm), pomimo faktu, że złoto ma więcej elektronów niż srebro! Powód takiego stanu rzeczy znajduje się w komentarzu poniżej.
Uwaga: Srebro jest lepszym przewodnikiem niż złoto, ale złoto jest bardziej pożądane, ponieważ nie koroduje. (Miedź jest najbardziej powszechne, ponieważ jest to najbardziej opłacalne) Odpowiedź jest nieco skomplikowana, a my strona tutaj jeden z najlepszych odpowiedzi widzieliśmy dla tych, którzy są zaznajomieni z materiału…
„Srebro siedzi w środku metali transistion około 1/2 drogi między gazów szlachetnych i metali alkalicznych. W kolumnie 11 układu okresowego wszystkie te pierwiastki (miedź, srebro i złoto) mają pojedynczy elektron s-orbitalny na zewnętrznej powłoce elektronowej (platyna również, w kolumnie 10).
Struktura orbitalna elektronów tych pierwiastków nie ma szczególnego powinowactwa do uzyskania elektronu lub utraty elektronu w kierunku gazów szlachetnych, które są cięższe lub lżejsze, ponieważ siedzą 1/2 drogi między nimi. Ogólnie oznacza to, że nie potrzeba wiele energii, aby chwilowo odrzucić elektron lub chwilowo go dodać. The specyficzny elektronowy affinities i potencjał jonizacji być zróżnicowany, i dotyczyć przewodzenie, mieć względny niski energia dla te dwa kryterium być trochę znacząco.
Gdyby to były jedyne kryteria, to złoto byłoby lepszym przewodnikiem niż srebro, ale złoto ma dodatkowe 14 elektronów f-orbitalnych pod 10 elektronami d-orbitalnymi i pojedynczym elektronem s-orbitalnym. Te 14 elektronów f jest spowodowane przez dodatkowe atomy w serii aktynowców. Z 14 dodatkowymi elektronami pozornie wypychającymi elektrony d i s można by pomyśleć, że elektron s po prostu siedzi tam „dojrzały” do przewodzenia (prawie żadna energia nie jest potrzebna aby go odepchnąć), ale NIE. Elektrony na orbitalu f są upakowane w taki sposób, że powoduje to, że promień atomu złota jest w rzeczywistości MNIEJSZY niż promień atomu srebra – nie o wiele, ale jest mniejszy. Mniejszy promień, oznacza większą siłę działającą z jądra na zewnętrzne elektrony, więc srebro wygrywa w „konkursie” przewodnictwa. Pamiętaj, że siła wynikająca z ładunku elektrycznego jest odwrotnie proporcjonalna do kwadratu odległości. Im bliżej siebie znajdują się 2 ładunki, tym większa jest siła między nimi.
Miedź i platyna mają jeszcze mniejsze średnice; stąd więcej przyciągania z jądra, stąd więcej energii do strącenia tego samotnego s-elektronu, stąd niższe przewodnictwo.
Inne elementy z pojedynczym elektronem s-orbitalnym siedzącym tam „dojrzałym dla zbieracza przewodnictwa, aby nadejść”, również mają niższe promienie atomowe (molibden, niob, chrom, ruten, rod) niż srebro.
Więc, to głównie to, gdzie siedzi — gdzie 'matka natura' umieściła srebro w układzie okresowym, dyktuje jego doskonałą przewodność.”
Źródło: tlbs101 Yahoo