ECG Pointers: Rozruszniki serca… i kiedy działają nieprawidłowo
Autor: David Bussé, MD, MBA (EM Resident Physician, UTSW / Parkland Memorial Hospital) // Edited by: Jamie Santistevan, MD (@jamie_rae_EMdoc – EM Physician, Presbyterian Hospital, Albuquerque, NM); Manpreet Singh, MD (@MPrizzleER – Assistant Professor of Emergency Medicine / Department of Emergency Medicine – Harbor-UCLA Medical Center); i Brit Long, MD (@long_brit – EM Attending Physician, San Antonio, TX)
Witamy w tej edycji ECG Pointers, serii emDOCs zaprojektowanej w celu zapewnienia wysokiej wydajności wskazówek na temat EKG, aby utrzymać swoje umiejętności interpretacji ostre. W celu pogłębienia wiedzy na temat EKG zamieszczamy linki do innych świetnych poradników dotyczących EKG!
Przypadek:
76-letni mężczyzna z HTN, DM, CAD i blokiem serca 3. stopnia po wszczepieniu stymulatora 8 lat temu zgłasza się na ostry dyżur z dusznością przy wysiłku i epizodem omdlenia w dniu dzisiejszym. Jego parametry życiowe to: T 37,2C, HR 38, BP 118/78, RR 18, O2 Sat 96% na powietrzu w pomieszczeniu. Pacjent, którego widzisz przed sobą, jest dobrze wyglądający i odpowiada na pytania. Jest w stanie powiedzieć, że z powodu problemów z ubezpieczeniem od 3 lat nie mógł umówić się na wizytę u kardiologa.
Jego wstępne EKG ujawnia co następuje:
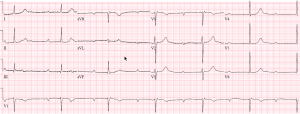
Funkcja rozrusznika serca

Rozruszniki serca składają się z wielu elementów:
- Generator impulsów zawiera baterię. Jest on wszczepiany w tkanki miękkie lub mięśnie przedniej ściany klatki piersiowej. Większość rozruszników serca ma żywotność baterii 5-10 lat . Żywotność baterii zależy od częstotliwości stymulacji, co utrudnia dokładne przewidywanie czasu jej trwania. Terminowa wymiana wymaga odpowiedniej obserwacji.
- Elektrody stymulatora łączą generator impulsów z mięśniem sercowym. W przypadku stymulatorów jednokomorowych elektrody umieszczane są w prawej komorze serca. Stymulatory dwujamowe mają elektrody w prawym przedsionku i prawej komorze. W przypadku stymulatorów dwujamowych (resynchronizujących) elektrody umieszcza się w prawym przedsionku, prawej komorze i zatoce wieńcowej (która stymuluje lewą komorę). Złamanie elektrod lub uszkodzenie izolowanej powłoki może prowadzić do nieprawidłowego działania stymulacji/odczytu.
- Stymulacja występuje, gdy różnica potencjałów (napięcie) jest przyłożona pomiędzy dwiema elektrodami. Próg stymulacji to minimalna ilość energii wymagana do depolaryzacji mięśnia sercowego, opisana przez amplitudę (wolty) i czas trwania. Cechy te są programowalne i wpływają na żywotność baterii.
Pacemakery są w pełni opisane przez 5 pozycyjny kod, przy czym pierwsze 3 pozycje określają funkcję urządzenia . Można je zapamiętać za pomocą mnemotechniki PaSeR1 – funkcja stymulacji, pozycja detekcji i odpowiedź na detekcję.
Najczęstszym ustawieniem dla urządzeń dwujamowych jest DDD , w którym stymulator stymuluje i wykrywa zarówno przedsionek jak i komorę. Jeśli wykryte zostanie pobudzenie natywne, stymulator zostaje zahamowany. Jeśli po upływie określonego czasu nie zostanie wykryte pobudzenie natywne, stymulator dostarcza pobudzenie wyzwolone.
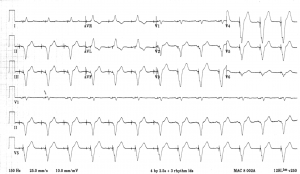
To jest pacjent z normalnie funkcjonującym stymulatorem DDD:
Nieprawidłowe działanie stymulatora
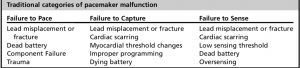
Nieprawidłowe działanie stymulatora tradycyjnie dzieli się na 3 kategorie:
- Niepowodzenie stymulacji sugeruje, że generator impulsów nie dostarcza wystarczającego napięcia wyjściowego do depolaryzacji mięśnia sercowego. W EKG nie widać kolców ani zespołów QRS wywołanych przez stymulator, ale raczej rytm natywny pacjenta.
- Niepowodzenie wychwytu ma miejsce, gdy impuls stymulatora jest podawany, ale nie jest on w stanie zdepolaryzować nierefrakcyjnej tkanki mięśnia sercowego. W EKG widoczne są impulsy stymulatora, ale nie ma odpowiedzi ze strony serca. Ponownie w EKG widoczny jest rytm natywny pacjenta. Przyczyną może być zwłóknienie powstałe w wyniku miejscowej reakcji zapalnej w kilka tygodni po implantacji (mniejsza częstość występowania ze względu na zastosowanie elektrod uwalniających steroidy), a także pęknięcie/rozklejenie elektrody, zespół twiddlera i perforacja serca.
- Niepowodzenie wyczuwania obejmuje zarówno oversensing, jak i undersensing. W przypadku oversensing, stymulator błędnie interpretuje inne sygnały (szczytowe załamki T, zakłócenia elektromagnetyczne, aktywność mięśni szkieletowych) jako zespoły QRS, hamując odpowiedź i nie inicjując stymulacji . W przypadku niedoczułości stymulator nie jest w stanie prawidłowo zinterpretować rodzimej aktywności serca z powodu zmian sygnałów wewnątrzsercowych (niedokrwienie mięśnia sercowego, nowe bloki odnogi pęczka Hisa, PVC). Czułość może być przeprogramowana w celu poprawy tych problemów.
- Ta historyczna kategoryzacja ma niewielką wartość w ostrym okresie, ponieważ jej przyczyny zwykle w dużym stopniu się pokrywają i wszystkie z nich są zarządzane podobnie.
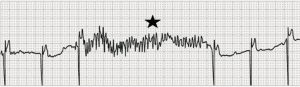
Przewrażliwienie miopotencjalne i hamowanie stymulacji: Aktywność mięśni szkieletowych jest mylona z aktywnością serca (gwiazdka), co skutkuje zahamowaniem stymulacji u pacjenta ze stymulatorem zaprogramowanym na tryb VVI.
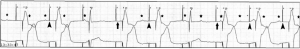
Undersensing i utrata wychwytu: Fale P są oznaczone gwiazdkami. Niedocenianie (grot strzałki) jest zauważalne, gdy po załamku P następuje krótko pik stymulacji. Utrata wychwytu (strzałka) jest odnotowywana, gdy po odpowiednio dobranym czasie stymulacji nie udaje się wygenerować załamka P.
Postępowanie w przypadku awarii rozrusznika serca
- Podejrzewać awarię rozrusznika serca na podstawie skarg na światłowstręt, zmęczenie, kołatanie serca, czkawkę, splątanie, duszność, drżenia mięśniowe i omdlenia.
- W wywiadzie należy ustalić, czy u pacjenta występują jakiekolwiek problemy prowadzące do nieprawidłowego działania rozrusznika serca. Należą do nich ACS, urazy, zmiany leków lub niedawne przeprogramowanie urządzenia.
- Pacjenci otrzymują karty z typem urządzenia, modelem, producentem i datą wszczepienia urządzenia.
- Prosić pacjentów o dostarczenie karty stymulatora serca.
- Badanie przedmiotowe należy rozpocząć od oceny parametrów życiowych, stanu psychicznego i stanu krążeniowo-oddechowego. Należy zwrócić uwagę na oznaki infekcji, migracji lub urazu w miejscu wszczepienia implantu. Należy również zwrócić uwagę na JVD, fale A, skurcze mięśni piersiowych i nowe szmery/rubienie w sercu.
- Wykonaj EKG, aby określić, czy występuje niestabilna bradykardia. Porównaj je z wcześniejszym EKG, zwracając szczególną uwagę na zmiany osi.
- W EKG pacjenta z pojedynczą komorą serca widoczne będą pobudzenia komorowe i LBBB z odchyleniem osi w lewo z powodu umieszczenia elektrody w RV.
- Stymulatory dwujamowe wychwytujące wolną ścianę LV wykazują dominującą falę R w odprowadzeniu V1 i kompleks QS w odprowadzeniu I, wskazując na czoło fali rozchodzące się od LV6.
- OdcinkiST i załamki T powinny być niezgodne z zespołem QRS.
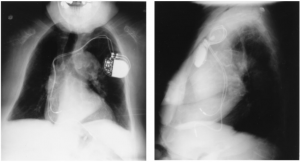
- Wykonaj PA i boczne zdjęcie radiologiczne klatki piersiowej, aby sprawdzić, czy nie doszło do przemieszczenia się elektrody, pęknięcia lub odmy opłucnowej. Jeżeli pacjent nie jest w stanie okazać karty stymulatora, można wykorzystać prześwietlone zdjęcie radiologiczne klatki piersiowej w celu ustalenia producenta urządzenia poprzez zidentyfikowanie symbolu firmy.
- Wykonaj pomiary stężenia elektrolitów w surowicy i wszelkich leków kardiotoksycznych oraz biomarkerów sercowych w odpowiednich warunkach. Zaburzenia metaboliczne, w tym niedoczynność tarczycy, kwasica i hipokaliemia mogą zmieniać potencjał progowy wymagany do stymulacji.
- Postępowanie jest podyktowane objawami pacjenta i stanem hemodynamicznym. Przezskórne elektrody stymulujące powinny być umieszczone na pacjencie w konfiguracji przednio-tylnej w każdym przypadku, gdy podejrzewa się nieprawidłowe działanie. W przypadku wystąpienia u pacjenta bradykardii z objawami hipoperfuzji należy zastosować standardowe protokoły ACLS.
- Gdy pacjent jest stabilny hemodynamicznie, przepytaj stymulator. Przesłuchanie dostarczy informacji na temat żywotności baterii, progów detekcji i stymulacji (under/oversensing), integralności systemu ołowiu (pęknięcie ołowiu) i zapisów rytmu serca. Przesłuchania mogą wskazywać na prawidłowe funkcjonowanie lub obecność arytmii, co pomaga w stratyfikacji ryzyka pacjenta.
- Przesłuchanie obejmuje komunikację o częstotliwości radiowej ze stymulatorem poprzez umieszczenie różdżki nad urządzeniem. Różdżka jest przymocowana do programatora, który wykonuje przesłuchanie i jest specyficzny dla każdej firmy produkującej urządzenia.
Oto przykład pacjenta z bradykardią pomimo wszczepienia rozrusznika serca:
Dysrytmie/syndromy wywołane przez rozrusznik serca:
- Stosować kryteria Sgarbossa u pacjentów z rozrusznikiem serca przy podejrzeniu ACS.
- Częstoskurcz z pośrednictwa stymulatora (Pacemaker-mediated tachycardia, PMT) jest częstoskurczem z pętlą reentry, unikalnym dla stymulatorów dwujamowych. PVC jest dostarczany do przedsionków w sposób wsteczny. Depolaryzacja komór stymuluje przedsionki, wyzwalając kolejną depolaryzację komór; w ten sposób powstaje pętla, w której dysrytmia osiąga górną granicę częstości stymulacji. Magnes kliniczny lub jakakolwiek terapia, która zwiększa okres refrakcji w węźle AV (adenozyna, CCBs, BBs) spowoduje przerwanie arytmii.
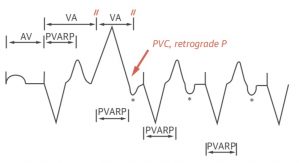
Tachykardia pośredniczona przez stymulator: Pierwsze pobudzenie ilustruje stymulację sekwencyjną AV, a następnie pobudzenie PVC. PVC rozpoczyna nowy odstęp VA. Każde zdarzenie odsprzęgające AV (najczęściej PVC) może przewodzić wstecznie do przedsionka. Zdarzenie przedsionkowe jest wyczuwalne, jeśli wypada poza okres refrakcji po-komorowej (PVARP). Odstęp VA wygasa, a nowy odstęp AV zostaje wyzwolony. Stymulacja komorowa pojawia się na końcu odstępu AV, tworząc okrężną serię zdarzeń określanych mianem częstoskurczu indukowanego przez stymulator.
- „Zachowanie górnej granicy częstości” może wywołać blok 2:1 . W trybie stymulacji dwujamowej urządzenie stymuluje w sposób 1:1 (A:V), aż do osiągnięcia zaprogramowanej górnej częstości rytmu komór. W miarę wzrostu częstości przedsionków stymulacja komorowa nie może naruszyć górnego limitu częstości, co powoduje stopniowe wydłużanie odstępów AV. W miarę wydłużania się odstępu AV może wystąpić nagły blok 2:1 z nagłym zwolnieniem częstości rytmu komór (częstość rytmu komór staje się połową maksymalnej częstości stymulacji), co wywołuje objawy.
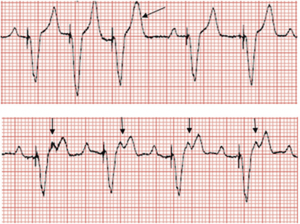
Zachowanie się górnej częstotliwości w stymulatorze dwujamowym: Przy wzroście częstości rytmu zatokowego powyżej 130 uderzeń na minutę, niektóre załamki P wpadają w okres PVARP (strzałki) i nie są śledzone. Postępujące wydłużenie PR jest widoczne przed zablokowanymi pobudzeniami (stymulator Wenckebacha). Kiedy częstość rytmu zatokowego osiąga TARP (odstęp AV + PVARP), co drugi załamek P wypada w PVARP i nie jest śledzony, co skutkuje efektywną częstością komór 75 uderzeń na minutę i nagłym spadkiem częstości akcji serca (częstość bloków 2:1 u tego pacjenta). To nie są wsteczne fale p.
- „Rozrusznik uciekający” wiąże się z dysfunkcją generatora rozrusznika. Częstość stymulacji jest większa niż zaprogramowany górny limit (do 400 bpm). W celu przerwania arytmii należy użyć magnesów klinicznych. Ostatecznością jest odłączenie przewodów od generatora impulsów (rozcięcie kieszeni).
- Zespół Twiddlera występuje, gdy pacjenci zaburzają/rozluźniają przewody manipulując generatorem. Badanie CXR wykaże skręcanie się przewodów wokół generatora. Konieczna jest korekta chirurgiczna.
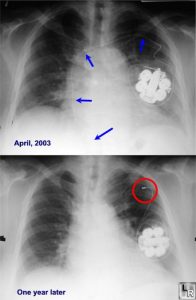
Sprawdź ten post na Learning Radiology: http://learningradiology.com/archives05/COW%20141-Twiddlers%20Syndrome/twiddlerscorrect.htm
- Zespół rozrusznika serca opisuje nietypowe objawy występujące u pacjenta (duszność, zawroty głowy, ból w klatce piersiowej, kołatanie serca) po wykluczeniu wszystkich innych przyczyn nieprawidłowego działania rozrusznika serca. Zespół ten, powszechny w przypadku stymulatorów jednokomorowych, jest spowodowany nieprawidłowym stosunkiem depolaryzacji między przedsionkami i komorami lub dyssynchronią AV. Skorygować poprzez optymalizację trybów/programowania stymulacji.
- Stosowanie MRI u pacjentów z rozrusznikiem serca jest przeciwwskazane ze względu na ryzyko wyzwolenia stymulacji o wysokiej częstotliwości . Rozruszniki warunkowe CMR są specjalnie zaprojektowane tak, aby były bezpieczne w środowisku MR, ale stanowią one zdecydowaną mniejszość urządzeń. Urządzenia warunkowe CMR mają minimalną ilość materiału ferromagnetycznego, zmienioną filtrację i przeprojektowane przewody ołowiu, aby zminimalizować indukcję prądu i ogrzewanie tkanek.
Dodatkowe rozważania:
- Pacjenci mogą zgłaszać się na izbę przyjęć wkrótce po wszczepieniu stymulatora z bólem i obrzękiem w miejscu wszczepienia.
- Krwawienie do kieszonki jest częstym powikłaniem i może spowodować rozcięcie płaszczyzn powięziowych. Duże krwiaki wymagają ewakuacji chirurgicznej. Nie aspirować!
- Erythema, obrzęk, wahania i dehiscencja miejsca nacięcia sugerują infekcję. Większość zakażeń jest spowodowana przez S. aures i S. epidermidis, więc empiryczne leczenie wankomycyną powinno być rozpoczęte w ED.
- Infekcje, które pojawiają się później mają tendencję do wpływania na elektrody rozrusznika serca. Należy podejrzewać bakteriemię, wegetacje elektrod i septyczne zatorowości płucne. Potwierdzić diagnozę posiewem krwi i TEE. Antybiotykiem z wyboru jest wankomycyna, ponieważ bakterie wywołujące chorobę są zwykle gram dodatnie. Ostateczne leczenie obejmuje chirurgiczne usunięcie elektrody.
- Umieszczenie stymulatora może również prowadzić do wysięków osierdziowych, odmy opłucnowej i krwotocznej. Należy spodziewać się takich prezentacji około 48 godzin po zabiegu z dolegliwościami w postaci duszności, bólu w klatce piersiowej i odmy podskórnej.
- Umieszczenie elektrody przez zastawkę trójdzielną może powodować dysfunkcję zastawki.
- Stymulatory mogą również migrować do bardziej powierzchownych płaszczyzn powięziowych w wyniku urazu, krwiaka lub miejscowego niedokrwienia tkanek. Taka migracja może powodować erozję ściany kieszonki, wymagającą chirurgicznego usunięcia i przemieszczenia.
- Ponieważ elektrody wchodzą do SVC, DVT może rozwinąć się wkrótce po założeniu lub wiele lat po implantacji. Zgłaszano występowanie zespołu SVC wtórnego do zakrzepicy żylnej.
- VTE mogą również zwiększać ryzyko nadciśnienia płucnego i udaru mózgu w przypadku drożności otworu owalnego (patent foramen ovale).
- Leczenie polega na wczesnej antykoagulacji, ale zwykle nie usuwa się elektrody, ponieważ może to spowodować rozszerzenie skrzepliny.
- Przemieszczenie się elektrody i migracja z mięśnia sercowego są częstymi powikłaniami w ciągu pierwszych 1-2 dni po implantacji. Włókniste przyleganie elektrody po implantacji zapobiega jej późnemu przemieszczeniu. Niemniej jednak ryzyko pozostaje, biorąc pod uwagę powtarzające się obciążenia mechaniczne w każdym cyklu pracy serca i ruchy obręczy barkowej.
- Szukajcie w obrazie CXR przemieszczonych elektrod w zatoce wieńcowej, LV, IVC, SVC, tętnicy płucnej lub w przedsionku poza przydatkiem.
- Uszkodzenie elektrody może również powodować zakrzepicę żył płucnych, perforację mięśnia sercowego i dysrytmię.
- Niewłaściwa pozycja ołowiu może powodować stymulację nerwu przeponowego z następowym pobudzeniem przepony i trudną do opanowania czkawką. Odnotowano większą częstość występowania stymulacji przeponowej w przypadku stymulatorów resynchronizujących.
- Wiele z tych obaw może zostać złagodzonych w najbliższej przyszłości wraz z pojawieniem się bezołowiowych stymulatorów serca, które kompresują systemy jednoskładnikowe do małej kapsułki, która znajduje się w sercu.
Zastosowanie magnesu klinicznego do stymulatora serca:
Postawienie magnesu klinicznego nad stymulatorem serca powoduje przejście urządzenia w tryb asynchroniczny, zwykle VOO lub DOO. Powoduje to stałą częstość stymulacji niezależnie od częstości lub rytmu natywnego. Magnesy kliniczne mają zwykle siłę ≥90 Gaussów, co znacznie przekracza wartość 10 Gaussów potrzebną do zmiany funkcji urządzenia. Jeśli przyłożenie magnesu nie powoduje żadnej odpowiedzi w EKG, nawet po zmianie położenia, należy rozważyć wyczerpanie baterii, dodać drugi magnes i rozważyć, że stymulator może być zaprogramowany tak, aby ignorował magnes.
Ta cecha jest przydatna do oceny wychwytu stymulatora i oceny żywotności baterii. Awarię baterii można wykluczyć, jeśli zespoły stymulacji nieobecne w podstawowym EKG pojawiają się po przyłożeniu magnesu. Magnes może być również użyty do przerwania częstoskurczu wywołanego przez stymulator. Ponadto, jeśli za przyczynę niestabilnej bradykardii uważa się nadmierne wyczuwanie, magnes można umieścić na urządzeniu stymulującym, aby zmienić jego ustawienia, eliminując w ten sposób funkcję wyczuwania i umożliwiając stymulację z ustaloną szybkością (zwykle 60-80 uderzeń na minutę). U osób otyłych może być potrzebny więcej niż jeden magnes .
Na koniec, z wyjątkiem stymulatorów Sorin, usunięcie magnesu powoduje powrót urządzenia do stymulacji z normalną, zaprogramowaną prędkością.
Dla więcej FOAMed sprawdzić ten post na Pacemaker Basics w REBEL EM: http://rebelem.com/pacemaker-basics/
- Allison, Michael G., i H. A. Mallemat. Emergency Care of Patients with Pacemakers and Defibrillators. Emergency Medicine Clinics of North America. 2015. 33(3). 653-667.
- Cardall, Taylor Y., et al. Permanent Cardiac Pacemakers: Issues Relevant to the Emergency Physician, Part I. The Journal of Emergency Medicine. 1999. 17(3). 479-489.
- Eifling, Michael, M. Razavi, and A. Massumi. The Evaluation and Management of Electrical Storm. Texas Heart Institute Journal. 2011. 38(2). 111-121.
- Jacob, Sony, et al. Cardiac Rhythm Device Identification Algorithm Using X-rays: CaRDIA-X. Heart Rhythm Society. 2011. 8(6). 915-922.
- Jacob, Sony, et al. Clinical Applications of Magnets on Cardiac Rhythm Management Devices. Europace. 2011. 13. 1222-1230.
- Madhavan, Malini, et al. Advances and Future Directions in Cardiac Pacemakers. Journal of the American College of Cardiology. 2017. 69(2). 211-235.
- McMullan, Jason, et al. Care of the Pacemaker/Implantable Cardioverter Defibrillator in the ED. American Journal of Emergency Medicine. 2007. 25. 812-822.
- Mulpuru, Siva, et al. Cardiac Pacemakers: Function, Troubleshooting, and Management. Journal of the American College of Cardiology. 2017. 69(2). 189-210.
.