Równowagi kompleksowo-jonowe
Rozpuszczalność
Dlaczego niektóre ciała stałe rozpuszczają się w wodzie?
Cukier, którego używamy do słodzenia kawy lub herbaty jest ciałem stałym molekularnym, w którym poszczególne cząsteczki są utrzymywane razem przez stosunkowo słabe siły międzycząsteczkowe. Kiedy cukier rozpuszcza się w wodzie, słabe wiązania pomiędzy poszczególnymi cząsteczkami sacharozy zostają zerwane, a cząsteczki C12H22O11 są uwalniane do roztworu.
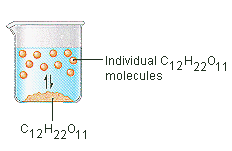
Potrzebna jest energia do zerwania wiązań pomiędzy cząsteczkami C12H22O11 w sacharozie. Potrzeba również energii, aby przerwać wiązania wodorowe w wodzie, które muszą być przerwane, aby wprowadzić jedną z tych cząsteczek sacharozy do roztworu. Cukier rozpuszcza się w wodzie, ponieważ energia jest wydzielana, gdy lekko polarne cząsteczki sacharozy tworzą wiązania międzycząsteczkowe z polarnymi cząsteczkami wody. Słabe wiązania, które tworzą się między solutem a rozpuszczalnikiem, kompensują energię potrzebną do zaburzenia struktury zarówno czystego solutu, jak i rozpuszczalnika. W przypadku cukru i wody proces ten przebiega tak dobrze, że do 1800 gramów sacharozy może rozpuścić się w litrze wody.
Ciała stałe jonowe (lub sole) zawierają jony dodatnie i ujemne, które są utrzymywane razem przez silną siłę przyciągania między cząsteczkami o przeciwnych ładunkach. Kiedy jedno z tych ciał stałych rozpuszcza się w wodzie, jony tworzące ciało stałe są uwalniane do roztworu, gdzie wiążą się z polarnymi cząsteczkami rozpuszczalnika.

| H2O | ||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) |
Możemy ogólnie założyć, że sole dysocjują na swoje jony, kiedy rozpuszczają się w wodzie. Związki jonowe rozpuszczają się w wodzie, jeśli energia wydzielana podczas interakcji jonów z cząsteczkami wody kompensuje energię potrzebną do zerwania wiązań jonowych w ciele stałym i energię potrzebną do oddzielenia cząsteczek wody, tak aby jony mogły zostać wprowadzone do roztworu.
![]()
Równowagi rozpuszczalności
Dyskusje o równowagach rozpuszczalności opierają się na następującym założeniu: Kiedy ciała stałe rozpuszczają się w wodzie, dysocjują dając cząstki elementarne, z których powstały. Tak więc, molekularne ciała stałe dysocjują, dając pojedyncze cząsteczki
| H2O | ||
| C12H22O11(s) | C12H22O11(aq) |
i jonowe ciała stałe dysocjują dając roztwory jonów dodatnich i ujemnych, które zawierają.
| H2O | ||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) |
Gdy sól jest dodawana po raz pierwszy, rozpuszcza się i szybko dysocjuje. Dlatego przewodnictwo roztworu początkowo szybko wzrasta.
| rozpuszcza się | ||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) | |
| dysocjować |

Stężenia tych jonów wkrótce staną się na tyle duże, że reakcja odwrotna zacznie konkurować z reakcją postępową, co prowadzi do zmniejszenia szybkości, z jaką jony Na+ i Cl- dostają się do roztworu.
| asocjują | ||||
| Na+(aq) | + | Cl-(aq) | NaCl(s) | |
| precypitat |
W końcu, stężenia jonów Na+ i Cl- stają się na tyle duże, że tempo wytrącania się wody dokładnie równoważy tempo rozpuszczania się NaCld. Gdy to się stanie, nie ma zmiany w stężeniu tych jonów z czasem i reakcja jest w równowadze. Kiedy układ ten osiąga równowagę, nazywany jest roztworem nasyconym, ponieważ zawiera maksymalne stężenie jonów, które mogą istnieć w równowadze z solą stałą. Ilość soli, która musi być dodana do danej objętości rozpuszczalnika, aby utworzyć roztwór nasycony, nazywana jest rozpuszczalnością soli.
![]()
Reguły rozpuszczalności
W danych uzyskanych z pomiarów rozpuszczalności różnych soli można znaleźć wiele prawidłowości. Wzorce te stanowią podstawę dla reguł przedstawionych w poniższej tabeli, które mogą być pomocne w przewidywaniu, czy dana sól rozpuści się w wodzie. Reguły te opierają się na następujących definicjach terminów: rozpuszczalny, nierozpuszczalny i słabo rozpuszczalny.
- Sól jest rozpuszczalna, jeśli rozpuszcza się w wodzie, dając roztwór o stężeniu co najmniej 0,1 mola na litr w temperaturze pokojowej.
- Sól jest nierozpuszczalna, jeżeli stężenie roztworu wodnego jest mniejsze niż 0,001 M w temperaturze pokojowej.
- Sole słabo rozpuszczalne dają roztwory, które mieszczą się pomiędzy tymi skrajnościami.
Reguły rozpuszczalności związków jonowych w wodzie
Sole rozpuszczalne
1. Jony Na+, K+ i NH4+ tworzą sole rozpuszczalne. Tak więc NaCl, KNO3, (NH4)2SO4, Na2S i (NH4)2CO3 są rozpuszczalne.
2. Jon azotanowy (NO3-) tworzy sole rozpuszczalne. Tak więc jony Cu(NO3)2 i Fe(NO3)3 są rozpuszczalne.
3. Jony chlorkowe (Cl-), bromkowe (Br-) i jodkowe (I-) zazwyczaj tworzą sole rozpuszczalne. Wyjątkiem od tej reguły są sole jonów Pb2+, Hg22+, Ag+ i Cu+. ZnCl2 jest rozpuszczalny, ale CuBr nie jest.
4. jon siarczanowy (SO42-) zazwyczaj tworzy sole rozpuszczalne. Wyjątki obejmują BaSO4, SrSO4 i PbSO4, które są nierozpuszczalne, oraz Ag2SO4, CaSO4 i Hg2SO4, które są słabo rozpuszczalne.
Sole nierozpuszczalne
1. Siarczki (S2-) są zazwyczaj nierozpuszczalne. Wyjątki obejmują Na2S, K2S, (NH4)2S, MgS, CaS, SrS i BaS.
2. Tlenki (O2-) są zazwyczaj nierozpuszczalne. Wyjątki obejmują Na2O, K2O, SrO, i BaO, które są rozpuszczalne, oraz CaO, który jest słabo rozpuszczalny.
3. Wodorotlenki (OH-) są zazwyczaj nierozpuszczalne. Wyjątki obejmują NaOH, KOH, Sr(OH)2 i Ba(OH)2, które są rozpuszczalne, oraz Ca(OH)2, który jest słabo rozpuszczalny.
4. Chromiany (CrO42-) są zazwyczaj nierozpuszczalne. Wyjątki obejmują Na2CrO4, K2CrO4, (NH4)2CrO4 i MgCrO4.
5. Fosforany (PO43-) i węglany (CO32-) są zazwyczaj nierozpuszczalne. Wyjątkiem są sole jonów Na+, K+ i NH4+.
![]()