8.3: pKa-Werte
Es ist hilfreich, eine Möglichkeit zu haben, die Bronsted-Lowry-Säuren verschiedener Verbindungen zu vergleichen. Wenn die Chemie der Protonen darin besteht, dass sie von einer saureren Stelle zu einer weniger sauren Stelle weitergegeben werden, dann wird die Stelle, die das Proton fester bindet, das Proton behalten, und die Stelle, die Protonen weniger fest bindet, wird das Proton verlieren. Wenn wir wissen, welche Stellen Protonen fester binden, können wir vorhersagen, in welche Richtung ein Proton übertragen wird.
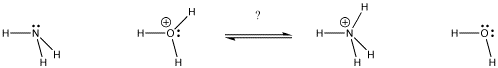
Abbildung AB9.1. In welcher Richtung wird das Gleichgewicht liegen? Welche Base bekommt das Proton?
Es gibt einen experimentell bestimmten Parameter, der uns sagt, wie fest Protonen an verschiedene Verbindungen gebunden sind. „Experimentell“ bedeutet für Schüler oft „ungetestet“ oder „unzuverlässig“, aber hier bedeutet es, dass jemand die Arbeit gemacht hat, zu messen, wie fest das Proton gebunden ist. Experimentell bedeutet in diesem Sinne „basierend auf physikalischen Beweisen“.
Dieser experimentelle Parameter wird „der pKa“ genannt. Der pKa misst, wie fest ein Proton von einer Brönsted-Säure gehalten wird. Ein pKa kann eine kleine, negative Zahl sein, wie -3 oder -5, oder eine größere, positive Zahl, wie 30 oder 50. Je niedriger der pKa einer Brönsted-Säure ist, desto leichter gibt sie ihr Proton ab. Je höher der pKa einer Brönsted-Säure ist, desto fester wird das Proton gehalten und desto weniger leicht wird das Proton abgegeben.
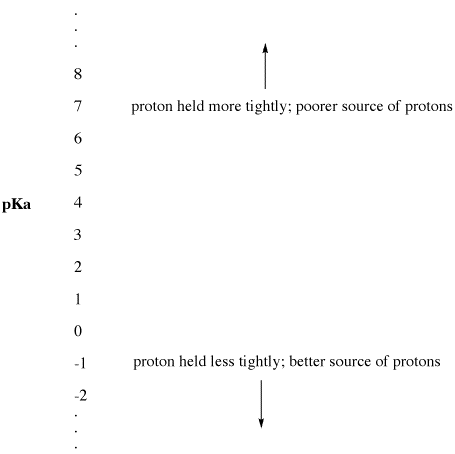
Abbildung AB9.2. Die pKa-Skala als Index der Protonenverfügbarkeit.
- Niedriges pKa bedeutet, dass ein Proton nicht fest gehalten wird.
- pKa kann manchmal so niedrig sein, dass es eine negative Zahl ist!
- Ein hoher pKa bedeutet, dass ein Proton fest gehalten wird.
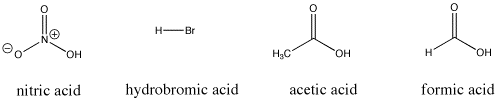
Abbildung AB9.3. Einige saure Bronsted-Verbindungen; diese Verbindungen geben alle relativ leicht Protonen ab.
Zum Beispiel geben sowohl Salpetersäure als auch Salzsäure ihre Protonen sehr leicht ab. Salpetersäure hat in Wasser einen pKa von -1,3 und Bromwasserstoffsäure einen pKa von -9,0. Andererseits geben Essigsäure (in Essig) und Ameisensäure (der Reizstoff in Ameisen- und Bienenstichen) ebenfalls Protonen ab, halten sie aber etwas fester. Ihre pKas werden mit 4,76 bzw. 3,77 angegeben. Wasser gibt nicht so leicht ein Proton ab; es hat einen pKa von 15,7. Methan ist eigentlich gar keine Säure und hat einen geschätzten pKa von etwa 50.

Abbildung AB9.4. Einige nicht-so-saure Verbindungen. Wasser ist sehr, sehr schwach sauer; Methan ist eigentlich gar nicht sauer.
Der pKa misst die „Stärke“ einer Brönsted-Säure. Ein Proton, H+, ist eine starke Lewis-Säure; es zieht sehr effektiv Elektronenpaare an, so sehr, dass es fast immer an einen Elektronendonor gebunden ist. Eine starke Brönsted-Säure ist eine Verbindung, die ihr Proton sehr leicht abgibt.
Eine schwache Brönsted-Säure ist eine Verbindung, die ihr Proton nur schwer abgibt. In einem weiteren Extremfall wird eine Verbindung, aus der es sehr, sehr schwierig ist, ein Proton zu entfernen, überhaupt nicht als Säure betrachtet.
Wenn eine Verbindung ein Proton abgibt, behält sie das Elektronenpaar, das sie zuvor mit dem Proton geteilt hat. Sie wird zu einer konjugierten Base. Anders betrachtet, gibt eine starke Brönsted-Säure leicht ein Proton ab und wird zu einer schwachen Brönsted-Base. Die Bronsted-Base kann nicht so leicht eine Bindung mit dem Proton eingehen. Sie ist nicht gut darin, ihr Elektronenpaar an ein Proton abzugeben. Sie tut dies nur schwach.
Auf ähnliche Weise, wenn eine Verbindung ein Proton abgibt und zu einer starken Base wird, nimmt die Base das Proton leicht wieder zurück. Effektiv konkurriert die starke Base so gut um das Proton, dass die Verbindung protoniert bleibt. Die Verbindung bleibt eine Bronsted-Säure, anstatt zu ionisieren und zur starken konjugierten Base zu werden. Sie ist eine schwache Brönsted-Säure.
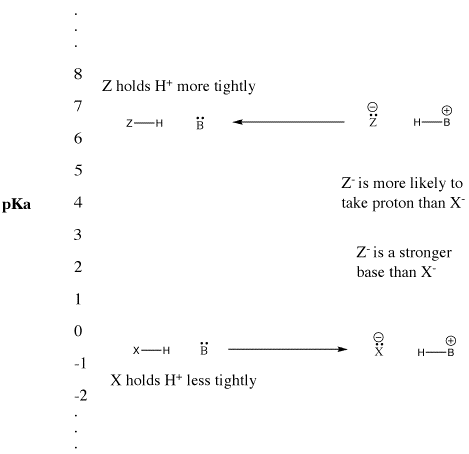
Abbildung AB9.5. Die pKa-Skala und ihre Auswirkung auf konjugierte Basen.
- „Starke“ Brönsted-Säuren ionisieren leicht und liefern H+.
- Dieser Begriff wird normalerweise verwendet, um gewöhnliche Säuren wie Schwefelsäure und Bromwasserstoffsäure zu beschreiben.
- „Schwache“ Brönsted-Säuren ionisieren nicht so leicht.
- Dieser Begriff wird oft verwendet, um gewöhnliche Säuren wie Essigsäure und Flusssäure zu beschreiben.
Doch die Begriffe „stark“ und „schwach“ sind wirklich relativ. pKa-Werte, die wir gesehen haben, reichen von -5 bis 50. Wenn etwas mit einem pKa von 4 als schwache Säure bezeichnet wird, was ist dann etwas mit einem pKa von 25? Eine sehr, sehr schwache Säure? Es ist sicherlich eine bessere Quelle für Protonen als etwas mit einem pKa von 35. Ist das eine sehr, sehr, sehr, sehr, sehr schwache Säure? Wie viele „verys“ gibt es in einer pKa-Einheit?
Dieser Gedanke gilt auch, wenn man das Gegenteil betrachtet: eine Base, die ein Proton aufnimmt, um eine konjugierte Säure zu bilden. Wie fest diese konjugierte Säure ein Proton hält, hängt damit zusammen, wie stark die Base Protonen aus anderen Säuren entfernen kann. Je schwächer etwas als Protonenquelle ist, desto stärker ist sein Konjugat als Protonenschwamm.
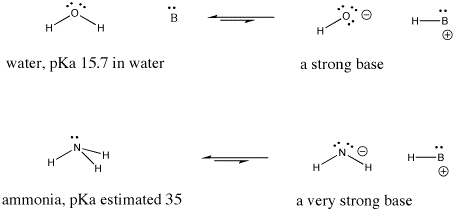
Abbildung AB9.6. Beispiele für eine starke und eine noch stärkere Base.
- Sein Sie vorsichtig. Die Begriffe „starke Säure“ und „schwache Säure“ können relativ und nicht absolut verwendet werden.
- Das gleiche gilt für „starke Base“ und „schwache Base“.
- Manchmal hängt es davon ab, ob etwas „stark“ oder „schwach“ genannt wird, womit es verglichen wird.
Problem AB9.1.
Finden Sie eine pKa-Tabelle. Benutzen Sie diese, um zu entscheiden, welches der folgenden Paare die stärkste Brönsted-Säure in Wasser ist.
a) HNO3 oder HNO2 b) H2Se oder H2O c) HCl oder H2SO4 d) Be(OH)2 oder HSeO3
Problem AB9.2.
Finden Sie eine pKa-Tabelle. Benutzen Sie diese, um zu entscheiden, welche der Verbindungen in jedem Paar das basischste Konjugat nach der Deprotonierung in Wasser bildet.
a) NH4+ oder NH3 b) HCN oder HSCN c) NH3 oder H2O
Beitragende
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)
Weiterführende Literatur
MasterOrganicChemistry
Säure-Base-Reaktionen 4 – pKa
Säure-Basen-Reaktionen 5 – Wie man eine pKa-Tabelle benutzt
Die pKa-Tabelle ist dein Freund
Khan Academy
Ka und pKa Ableitung
Websites
Wikipedia – Säure-Dissoziationskonstanten
Acidität, Basizität und pKa (PDF)