8.3: pKa Waarden
Het is nuttig om een manier te hebben om Bronsted-Lowry zuurtegraden van verschillende verbindingen te vergelijken. Als de chemie van protonen inhoudt dat ze van een zuurdere plaats naar een minder zure plaats gaan, dan zal de plaats die het proton beter bindt het proton behouden, en de plaats die protonen minder goed bindt zal het proton verliezen. Als we weten welke plaatsen protonen sterker binden, kunnen we voorspellen in welke richting een proton zal worden verplaatst.
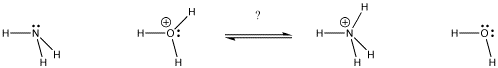
Figuur AB9.1. In welke richting komt het evenwicht te liggen? Welke base krijgt het proton?
Er is een experimenteel bepaalde parameter die ons vertelt hoe stevig protonen aan verschillende verbindingen gebonden zijn. “Experimenteel’ betekent voor studenten vaak ‘ongetest’ of ‘onbetrouwbaar’, maar hier betekent het dat iemand het werk heeft gedaan om te meten hoe sterk het proton gebonden is. Experimenteel in deze zin betekent “gebaseerd op fysisch bewijs”.
Deze experimentele parameter wordt “de pKa” genoemd. De pKa meet hoe stevig een proton wordt vastgehouden door een Bronsted zuur. Een pKa kan een klein, negatief getal zijn, zoals -3 of -5. Het kan ook een groter, positief getal zijn, zoals 30 of 50. Hoe lager de pKa van een Bronsted zuur, hoe gemakkelijker het zijn proton afgeeft. Hoe hoger de pKa van een Bronsted zuur, hoe vaster het proton wordt vastgehouden, en hoe minder gemakkelijk het proton wordt afgestaan.
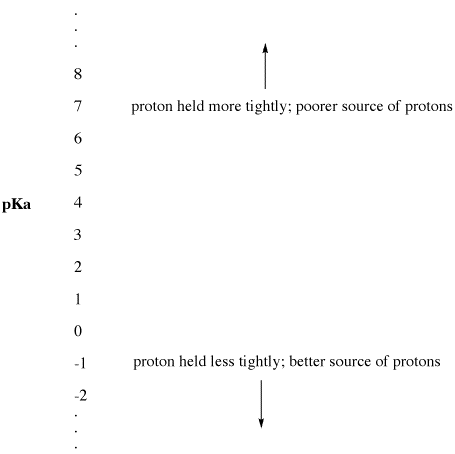
Figuur AB9.2. De pKa-schaal als index van protonbeschikbaarheid.
- Lage pKa betekent dat een proton niet goed wordt vastgehouden.
- pKa kan soms zo laag zijn dat het een negatief getal is!
- Een hoge pKa betekent dat een proton stevig wordt vastgehouden.
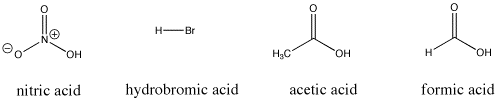
Figuur AB9.3. Enkele Bronstedische zure verbindingen; deze verbindingen geven alle relatief gemakkelijk protonen af.
Bijv. salpeterzuur en zoutzuur geven beide zeer gemakkelijk hun protonen af. Salpeterzuur in water heeft een pKa van -1,3 en waterstofbroomzuur heeft een pKa van -9,0. Anderzijds geven azijnzuur (in azijn) en mierenzuur (de irriterende stof in mieren- en bijensteken) ook protonen af, maar houden ze die iets vaster. Hun pKa’s worden gerapporteerd als respectievelijk 4,76 en 3,77. Water geeft niet zo gemakkelijk een proton af; het heeft een pKa van 15,7. Methaan is eigenlijk helemaal geen zuur, en heeft een geschatte pKa van ongeveer 50.

Figuur AB9.4. Enkele niet-zure verbindingen. Water is zeer, zeer zwak zuur; methaan is eigenlijk helemaal niet zuur.
De pKa meet de “sterkte” van een Bronsted zuur. Een proton, H+, is een sterk Lewiszuur; het trekt zeer effectief elektronenparen aan, zozeer zelfs dat het bijna altijd aan een elektronendonor vastzit. Een sterk Bronsted zuur is een verbinding die zijn proton zeer gemakkelijk afgeeft
Een zwak Bronsted zuur is een verbinding die zijn proton met meer moeite afgeeft. Nog extremer: een verbinding waaruit het proton zeer moeilijk te verwijderen is, wordt helemaal niet als zuur beschouwd.
Wanneer een verbinding een proton afstaat, behoudt zij het elektronenpaar dat zij vroeger met het proton deelde. Het wordt een geconjugeerde base. Anders gezegd, een sterk Bronsted zuur geeft gemakkelijk een proton af en wordt een zwakke Bronsted base. De Bronsted base vormt niet gemakkelijk een binding met het proton. Hij is niet goed in het afstaan van zijn elektronenpaar aan een proton. Hij doet dat slechts zwak.
Op soortgelijke wijze, als een verbinding een proton afstaat en een sterke base wordt, zal de base het proton gemakkelijk weer terugnemen. In feite concurreert de sterke base zo goed om het proton dat de verbinding geprotoneerd blijft. De verbinding blijft een Bronsted zuur in plaats van te ioniseren en de sterke geconjugeerde base te worden. Het is een zwak Bronsted zuur.
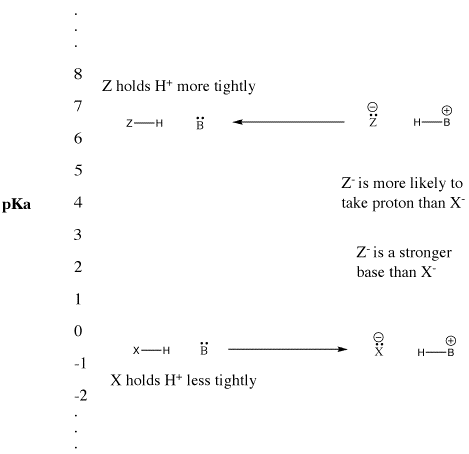
Figuur AB9.5. De pKa-schaal en het effect op geconjugeerde basen.
- “Sterke” Bronsted zuren ioniseren gemakkelijk en leveren H+.
- Deze term wordt meestal gebruikt om gewone zuren te beschrijven, zoals zwavelzuur en waterstofbromidezuur.
- “Zwakke” Bronsted zuren ioniseren niet zo gemakkelijk.
- Deze term wordt vaak gebruikt om gewone zuren zoals azijnzuur en fluorwaterstofzuur te beschrijven.
De termen “sterk” en “zwak” zijn echter echt relatief. pKa waarden die we hebben gezien variëren van -5 tot 50. Als iets met een pKa van 4 wordt omschreven als een zwak zuur, wat is dan iets met een pKa van 25? Een zeer, zeer zwak zuur? Het is zeker een betere bron van protonen dan iets met een pKa van 35. Is dat een heel, heel, heel, heel zwak zuur? Hoeveel “verys” zitten er in een pKa eenheid?
Dit idee gaat ook op als je het omgekeerde bekijkt: een base die een proton opneemt om een geconjugeerd zuur te vormen. Hoe stevig dat geconjugeerde zuur een proton vasthoudt, hangt samen met hoe sterk de base protonen kan verwijderen uit andere zuren. Hoe zwakker iets is als bron van protonen, hoe sterker zijn conjugaat is als protonspons.
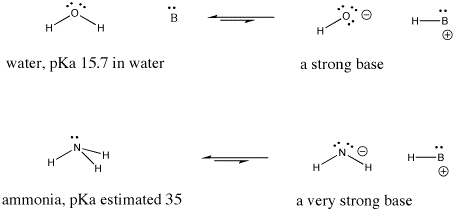
Figuur AB9.6. Voorbeelden van een sterke base en een nog sterkere base.
- Wees voorzichtig. De termen “sterk zuur” en “zwak zuur” kun je relatief gebruiken, in plaats van absoluut.
- Hetzelfde geldt voor “sterke base” en “zwakke base”.
- Soms hangt het ervan af waarmee het vergeleken wordt of iets “sterk” of “zwak” genoemd wordt.
Opgave AB9.1.
Vind een pKa-tabel. Gebruik die om te bepalen welk van de volgende paren het meest Bronstedzuur is in water.
a) HNO3 of HNO2 b) H2Se of H2O c) HCl of H2SO4 d) Be(OH)2 of HSeO3
Probleem AB9.2.
Vind een pKa-tabel. Gebruik deze om te bepalen welke van de verbindingen in elk paar het meest basische conjugaat vormt na deprotonatie in water.
a) NH4+ of NH3 b) HCN of HSCN c) NH3 of H2O
Contributors
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)
Verder lezen
MasterOrganicChemistry
Zuur-Base Reacties 4 – pKa
Zuur-Base Reacties 5 – Hoe gebruik je een pKa tabel
De pKa tabel is je vriend
Khan Academy
Ka en pKa afleiding
Websites
Wikipedia – Zuur Dissociatie Constanten
Zuurgraad, Basiciteit en pKa (PDF)