8.3 : Valeurs du pKa
Il est utile d’avoir un moyen de comparer les acidités de Bronsted-Lowry de différents composés. Si la chimie des protons consiste à les faire passer d’un site plus acide à un site moins acide, alors le site qui lie le proton de façon plus serrée conservera le proton, et le site qui lie les protons de façon moins serrée perdra le proton. Si l’on sait quels sites fixent les protons de manière plus serrée, on peut prédire dans quelle direction un proton sera transféré.
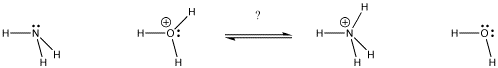
Figure AB9.1. Dans quelle direction se situera l’équilibre ? Quelle base obtient le proton ?
Il existe un paramètre déterminé expérimentalement qui nous indique à quel point les protons sont liés aux différents composés. « Expérimental » implique souvent pour les étudiants « non testé » ou « non fiable », mais ici cela signifie que quelqu’un a fait le travail pour mesurer à quel point le proton est lié. Expérimental dans ce sens signifie « basé sur des preuves physiques ».
Ce paramètre expérimental est appelé « le pKa ». Le pKa mesure la force avec laquelle un proton est retenu par un acide de Bronsted. Le pKa peut être un petit nombre négatif, tel que -3 ou -5, ou un nombre positif plus grand, tel que 30 ou 50. Plus le pKa d’un acide de Bronsted est faible, plus il cède facilement son proton. Plus le pKa d’un acide de Bronsted est élevé, plus le proton est retenu et moins il cède facilement son proton.
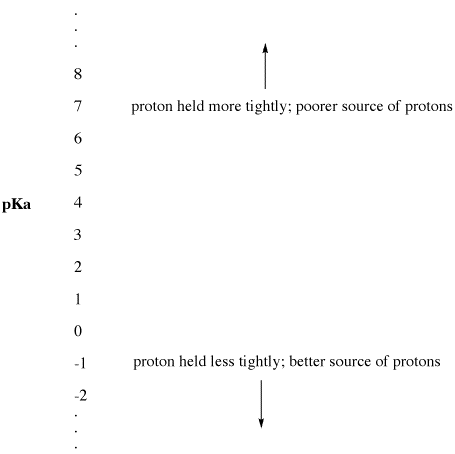
Figure AB9.2. L’échelle du pKa comme indice de disponibilité des protons.
- Un pKa faible signifie qu’un proton n’est pas retenu fermement.
- Le pKa peut parfois être si faible qu’il est un nombre négatif !
- Un pKa élevé signifie qu’un proton est retenu fermement.
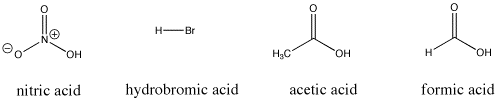
Figure AB9.3. Quelques composés acides de Bronsted ; ces composés fournissent tous des protons relativement facilement.
Par exemple, l’acide nitrique et l’acide chlorhydrique cèdent tous deux leurs protons très facilement. L’acide nitrique dans l’eau a un pKa de -1,3 et l’acide bromhydrique un pKa de -9,0. D’autre part, l’acide acétique (présent dans le vinaigre) et l’acide formique (l’irritant des piqûres de fourmis et d’abeilles) cèdent également leurs protons, mais les retiennent un peu plus fermement. Leurs pKa sont respectivement de 4,76 et 3,77. L’eau ne cède pas très facilement un proton ; son pKa est de 15,7. Le méthane n’est pas vraiment un acide du tout, et son pKa est estimé à environ 50.

Figure AB9.4. Quelques composés pas si acides. L’eau est très, très faiblement acide ; le méthane n’est pas vraiment acide du tout.
Le pKa mesure la » force » d’un acide de Bronsted. Un proton, H+, est un acide de Lewis fort ; il attire très efficacement les paires d’électrons, à tel point qu’il est presque toujours attaché à un donneur d’électrons. Un acide de Bronsted fort est un composé qui cède son proton très facilement.
Un acide de Bronsted faible est un composé qui cède son proton avec plus de difficulté. En allant à un extrême plus loin, un composé dont il est très, très difficile d’enlever un proton n’est pas du tout considéré comme un acide.
Lorsqu’un composé abandonne un proton, il conserve la paire d’électrons qu’il partageait auparavant avec le proton. Il devient alors une base conjuguée. Vu d’une autre manière, un acide de Bronsted fort cède facilement un proton, devenant une base de Bronsted faible. La base de Bronsted ne forme pas facilement une liaison avec le proton. Elle n’est pas douée pour donner sa paire d’électrons à un proton. Elle ne le fait que faiblement.
De la même manière, si un composé abandonne un proton et devient une base forte, la base reprendra facilement le proton. Effectivement, la base forte rivalise si bien pour le proton que le composé reste protoné. Le composé reste un acide de Bronsted au lieu de s’ioniser et de devenir la base forte conjuguée. C’est un acide de Bronsted faible.
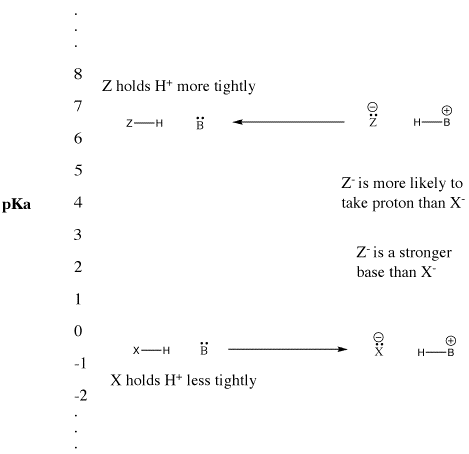
Figure AB9.5. L’échelle du pKa et son effet sur les bases conjuguées.
- Les acides de Bronsted « forts » s’ionisent facilement pour fournir H+.
- Ce terme est généralement utilisé pour décrire des acides courants comme l’acide sulfurique et l’acide bromhydrique.
- Les acides de Bronsted « faibles » ne s’ionisent pas aussi facilement.
- Ce terme est souvent utilisé pour décrire des acides courants comme l’acide acétique et l’acide fluorhydrique.
Cependant, les termes « fort » et « faible » sont vraiment relatifs. Les valeurs de pKa que nous avons vues vont de -5 à 50. Si un produit dont le pKa est de 4 est décrit comme un acide faible, qu’en est-il d’un produit dont le pKa est de 25 ? Un acide très, très faible ? C’est certainement une meilleure source de protons que quelque chose avec un pKa de 35. Est-ce un acide très, très, très, très faible ? Combien de » verys » y a-t-il dans une unité de pKa ?
Cette idée est également vraie lorsqu’on considère l’inverse : une base captant un proton pour former un acide conjugué. La façon dont cet acide conjugué retient un proton est liée à la force avec laquelle la base peut enlever les protons des autres acides. Plus un élément est faible en tant que source de protons, plus son conjugué est fort en tant qu’éponge à protons.
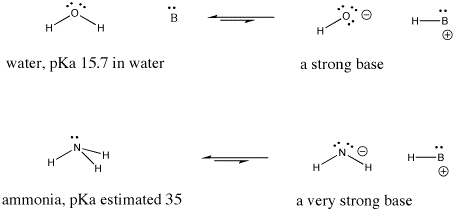
Figure AB9.6. Exemples d’une base forte et d’une base encore plus forte.
- Attention. Les termes « acide fort » et « acide faible » peuvent être utilisés de manière relative, plutôt qu’absolue.
- Il en est de même pour « base forte » et « base faible ».
- Parfois, le fait qu’une chose soit appelée « forte » ou « faible » dépend de ce à quoi elle est comparée.
Problème AB9.1.
Trouvez un tableau de pKa. Utilisez-le pour vous aider à décider lequel des couples suivants est le plus acide de Bronsted dans l’eau.
a) HNO3 ou HNO2 b) H2Se ou H2O c) HCl ou H2SO4 d) Be(OH)2 ou HSeO3
Problème AB9.2.
Trouvez une table de pKa. Utilisez-la pour vous aider à décider lequel des composés de chaque paire forme le conjugué le plus basique après déprotonation dans l’eau.
a) NH4+ ou NH3 b) HCN ou HSCN c) NH3 ou H2O
Contributeurs
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)
Lectures complémentaires
MasterOrganicChemistry
Réactions acide-base 4 – pKa
Réactions acide-base 5 – Comment utiliser le pKa ?Base 5 – Comment utiliser un tableau pKa
Le tableau pKa est votre ami
Khan Academy
Dérivation du Ka et du pKa
Sites web
Wikipedia – Constantes de dissociation des acides
Acidité, Basicité et pKa (PDF)
.