8.3: Valores pKa
Es útil tener una forma de comparar las acideces de Bronsted-Lowry de diferentes compuestos. Si la química de los protones implica el paso de un sitio más ácido a un sitio menos ácido, entonces el sitio que une el protón más fuertemente retendrá el protón, y el sitio que une los protones menos fuertemente perderá el protón. Si sabemos qué sitios unen los protones más fuertemente, podemos predecir en qué dirección se transferirá un protón.
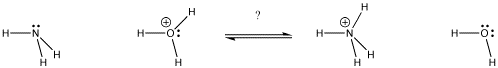
Figura AB9.1. En qué dirección estará el equilibrio? ¿Qué base se queda con el protón?
Hay un parámetro determinado experimentalmente que nos indica la fuerza con la que se unen los protones a los diferentes compuestos. «Experimental» a menudo implica para los estudiantes «no probado» o «poco fiable», pero aquí significa que alguien ha hecho el trabajo para medir la fuerza con la que se une el protón. Experimental en este sentido significa «basado en evidencia física».
Este parámetro experimental se llama «el pKa». El pKa mide la fuerza con la que un protón es retenido por un ácido de Bronsted. Un pKa puede ser un número pequeño y negativo, como -3 o -5. Puede ser un número mayor y positivo, como 30 o 50. Cuanto menor sea el pKa de un ácido de Bronsted, más fácilmente cederá su protón. Cuanto más alto sea el pKa de un ácido de Bronsted, más fuertemente se mantiene el protón y menos fácilmente se cede.
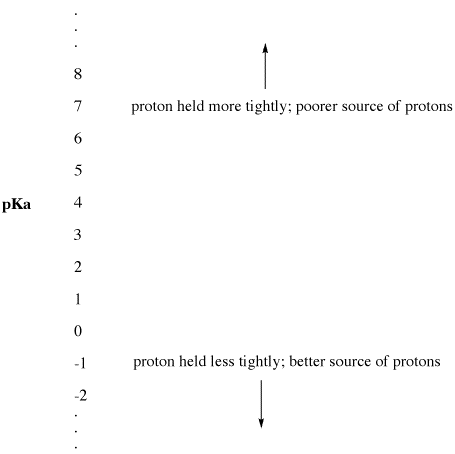
Figura AB9.2. La escala de pKa como índice de disponibilidad de protones.
- Un pKa bajo significa que un protón no está bien sujeto.
- ¡El pKa puede ser a veces tan bajo que es un número negativo!
- Un pKa alto significa que el protón se mantiene firme.
- Los ácidos de Bronsted «fuertes» se ionizan fácilmente para proporcionar H+.
- Este término se suele utilizar para describir ácidos comunes como el ácido sulfúrico y el ácido bromhídrico.
- Los ácidos de Bronsted «débiles» no se ionizan tan fácilmente.
- Este término se utiliza a menudo para describir ácidos comunes como el ácido acético y el ácido fluorhídrico.
- Tenga cuidado. Los términos «ácido fuerte» y «ácido débil» pueden utilizarse de forma relativa, en lugar de absoluta.
- Lo mismo ocurre con «base fuerte» y «base débil».
- A veces, que algo se llame «fuerte» o «débil» depende de con qué otra cosa se esté comparando.
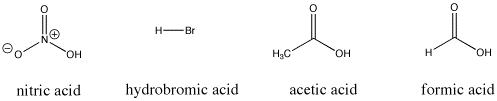
Figura AB9.3. Algunos compuestos ácidos de Bronsted; todos estos compuestos ceden protones con relativa facilidad.
Por ejemplo, el ácido nítrico y el ácido clorhídrico ceden sus protones con mucha facilidad. El ácido nítrico en agua tiene un pKa de -1,3 y el ácido bromhídrico tiene un pKa de -9,0. Por otro lado, el ácido acético (que se encuentra en el vinagre) y el ácido fórmico (el irritante de las picaduras de hormigas y abejas) también ceden protones, pero los retienen un poco más. Sus pKas son 4,76 y 3,77, respectivamente. El agua no cede fácilmente un protón; tiene un pKa de 15,7. El metano no es realmente un ácido, y tiene un pKa estimado de aproximadamente 50.

Figura AB9.4. Algunos compuestos no tan ácidos. El agua es muy, muy débilmente ácida; el metano no es realmente ácido en absoluto.
El pKa mide la «fuerza» de un ácido de Bronsted. Un protón, H+, es un ácido de Lewis fuerte; atrae pares de electrones de forma muy eficaz, tanto que casi siempre está unido a un donante de electrones. Un ácido de Bronsted fuerte es un compuesto que cede su protón muy fácilmente.
Un ácido de Bronsted débil es aquel que cede su protón con más dificultad. Yendo a un extremo más lejano, un compuesto del que es muy, muy difícil eliminar un protón no se considera un ácido en absoluto.
Cuando un compuesto cede un protón, retiene el par de electrones que antes compartía con el protón. Se convierte en una base conjugada. Visto de otra manera, un ácido de Bronsted fuerte cede un protón fácilmente, convirtiéndose en una base de Bronsted débil. La base de Bronsted no forma fácilmente un enlace con el protón. No es buena para donar su par de electrones a un protón. Lo hace sólo débilmente.
De manera similar, si un compuesto cede un protón y se convierte en una base fuerte, la base volverá a tomar el protón fácilmente. En efecto, la base fuerte compite tan bien por el protón que el compuesto permanece protonado. El compuesto sigue siendo un ácido de Bronsted en lugar de ionizarse y convertirse en la base fuerte conjugada. Es un ácido de Bronsted débil.
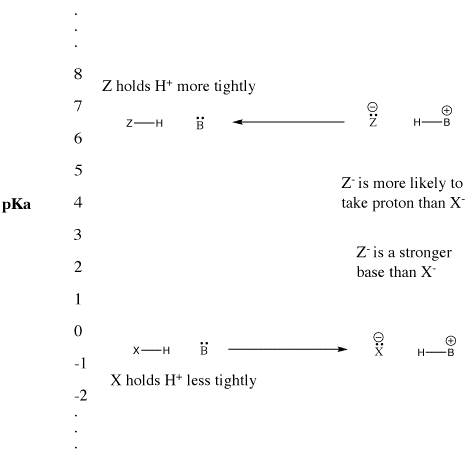
Figura AB9.5. La escala de pKa y su efecto sobre las bases conjugadas.
Sin embargo, los términos «fuerte» y «débil» son realmente relativos. Los valores de pKa que hemos visto van de -5 a 50. Si algo con un pKa de 4 se describe como un ácido débil, ¿qué es algo con un pKa de 25? ¿Un ácido muy, muy débil? Ciertamente es una mejor fuente de protones que algo con un pKa de 35. ¿Es un ácido muy, muy, muy, muy débil? ¿Cuántos «verys» hay en una unidad de pKa?
Esta idea también es cierta cuando se considera lo contrario: una base que recoge un protón para formar un ácido conjugado. La fuerza con la que ese ácido conjugado retiene un protón está relacionada con la fuerza con la que la base puede eliminar protones de otros ácidos. Cuanto más débil es algo como fuente de protones, más fuerte es su conjugado como esponja de protones.
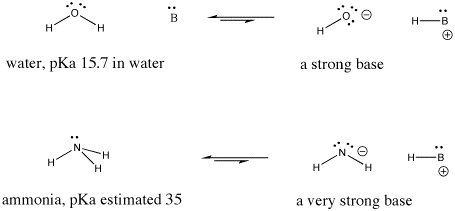
Figura AB9.6. Ejemplos de una base fuerte y otra aún más fuerte.
Encuentra una tabla de pKa. Utilízala para ayudarte a decidir cuál de los siguientes pares es el más ácido de Bronsted en el agua.
a) HNO3 o HNO2 b) H2Se o H2O c) HCl o H2SO4 d) Be(OH)2 o HSeO3
Encuentra una tabla de pKa. Utilízala para ayudarte a decidir cuál de los compuestos de cada par forma el conjugado más básico tras la desprotonación en agua.
a) NH4+ o NH3 b) HCN o HSCN c) NH3 o H2O
Contribuidores
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)
Las lecturas adicionales
MasterOrganicChemistry
Reacciones ácido-base 4 – pKa
Reacciones ácido-base 5 – Cómo se puede hacer un análisis de la base.Reacciones Base 5 – Cómo usar una tabla de pKa
La tabla de pKa es tu amiga
Academia Khan
Derivación de Ka y pKa
Sitios web
Wikipedia – Constantes de disociación de los ácidos
Acidez, Basicidad y pKa (PDF)