8.3: Valori pKa
È utile avere un modo per confrontare le acidità Bronsted-Lowry di diversi composti. Se la chimica dei protoni comporta il passaggio da un sito più acido a un sito meno acido, allora il sito che lega il protone più strettamente tratterrà il protone, e il sito che lega i protoni meno strettamente perderà il protone. Se sappiamo quali siti legano più strettamente i protoni, possiamo prevedere in quale direzione sarà trasferito un protone.
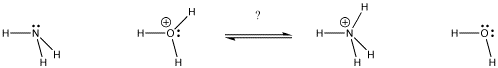
Figura AB9.1. In quale direzione si troverà l’equilibrio? Quale base ottiene il protone?
C’è un parametro determinato sperimentalmente che ci dice quanto strettamente i protoni sono legati ai diversi composti. “Sperimentale” spesso implica per gli studenti “non testato” o “inaffidabile”, ma qui significa che qualcuno ha fatto il lavoro per misurare quanto strettamente il protone è legato. Sperimentale in questo senso significa “basato su prove fisiche”.
Questo parametro sperimentale è chiamato “il pKa”. Il pKa misura quanto strettamente un protone è trattenuto da un acido di Bronsted. Un pKa può essere un numero piccolo e negativo, come -3 o -5. Può essere un numero più grande e positivo, come 30 o 50. Più basso è il pKa di un acido di Bronsted, più facilmente cede il suo protone. Più alto è il pKa di un acido di Bronsted, più strettamente il protone è trattenuto, e meno facilmente il protone è ceduto.
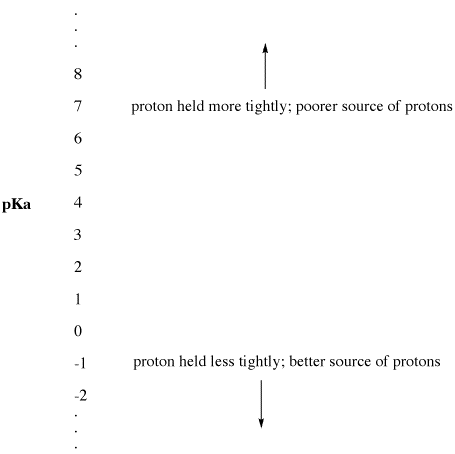
Figura AB9.2. La scala pKa come indice di disponibilità del protone.
- PKa basso significa che un protone non è tenuto saldamente.
- pKa può talvolta essere così basso da essere un numero negativo!
- Un pKa alto significa che un protone è tenuto ben stretto.
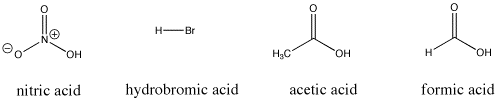
Figura AB9.3. Alcuni composti acidi di Bronsted; questi composti forniscono tutti protoni relativamente facilmente.
Per esempio, l’acido nitrico e l’acido cloridrico cedono entrambi i loro protoni molto facilmente. L’acido nitrico in acqua ha un pKa di -1,3 e l’acido bromidrico ha un pKa di -9,0. D’altra parte, l’acido acetico (che si trova nell’aceto) e l’acido formico (l’irritante nelle punture di formiche e api) cedono anch’essi i protoni, ma li trattengono un po’ più strettamente. I loro pKa sono riportati come 4,76 e 3,77, rispettivamente. L’acqua non cede un protone molto facilmente; ha un pKa di 15,7. Il metano non è proprio un acido, e ha un pKa stimato di circa 50.

Figura AB9.4. Alcuni composti non troppo acidi. L’acqua è molto, molto debolmente acida; il metano non è affatto acido.
Il pKa misura la “forza” di un acido di Bronsted. Un protone, H+, è un acido di Lewis forte; attrae coppie di elettroni in modo molto efficace, tanto che è quasi sempre attaccato a un donatore di elettroni. Un acido di Bronsted forte è un composto che cede il suo protone molto facilmente.
Un acido di Bronsted debole è un composto che cede il suo protone con più difficoltà. Andando all’estremo opposto, un composto da cui è molto, molto difficile rimuovere un protone non è considerato affatto un acido.
Quando un composto cede un protone, mantiene la coppia di elettroni che prima condivideva con il protone. Diventa una base coniugata. Visto in un altro modo, un acido forte di Bronsted cede facilmente un protone, diventando una base debole di Bronsted. La base di Bronsted non forma facilmente un legame con il protone. Non è brava a donare la sua coppia di elettroni a un protone. Lo fa solo debolmente.
In modo simile, se un composto cede un protone e diventa una base forte, la base riprenderà facilmente il protone. In effetti, la base forte compete così bene per il protone che il composto rimane protonato. Il composto rimane un acido di Bronsted piuttosto che ionizzarsi e diventare la base coniugata forte. È un acido debole di Bronsted.
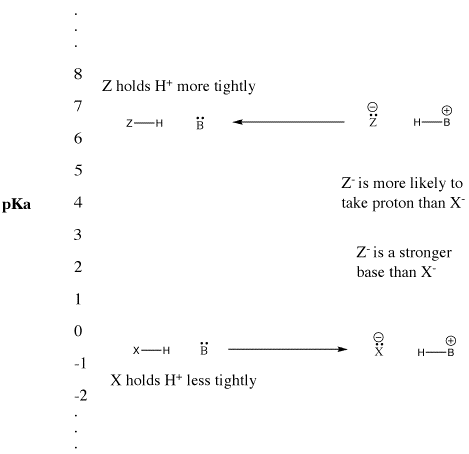
Figura AB9.5. La scala pKa e il suo effetto sulle basi coniugate.
- Gli acidi Bronsted “forti” si ionizzano facilmente per fornire H+.
- Questo termine è di solito usato per descrivere acidi comuni come l’acido solforico e l’acido bromidrico.
- Gli acidi Bronsted “deboli” non si ionizzano così facilmente.
- Questo termine è spesso usato per descrivere acidi comuni come l’acido acetico e l’acido fluoridrico.
Tuttavia, i termini “forte” e “debole” sono davvero relativi. I valori pKa che abbiamo visto vanno da -5 a 50. Se qualcosa con un pKa di 4 è descritto come un acido debole, cos’è qualcosa con un pKa di 25? Un acido molto, molto debole? È certamente una migliore fonte di protoni di qualcosa con un pKa di 35. È un acido molto, molto, molto, molto, molto debole? Quanti “veri” ci sono in un’unità pKa?
Questa idea è vera anche quando si considera il contrario: una base che raccoglie un protone per formare un acido coniugato. Quanto strettamente quell’acido coniugato trattiene un protone è legato a quanto fortemente la base può rimuovere protoni da altri acidi. Più qualcosa è debole come fonte di protoni, più forte è il suo coniugato come spugna protonica.
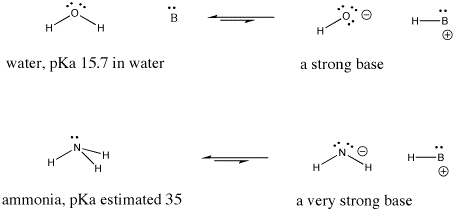
Figura AB9.6. Esempi di una base forte e di una ancora più forte.
- Fate attenzione. I termini “acido forte” e “acido debole” possono essere usati relativamente, piuttosto che assolutamente.
- Lo stesso vale per “base forte” e “base debole”.
- A volte, se qualcosa viene chiamato “forte” o “debole” dipende da cos’altro viene paragonato.
Problema AB9.1.
Trova una tabella pKa. Usala per aiutarti a decidere quale delle seguenti coppie è la più acida di Bronsted in acqua.
a) HNO3 o HNO2 b) H2Se o H2O c) HCl o H2SO4 d) Be(OH)2 o HSeO3
Problema AB9.2.
Trova una tabella pKa. Usala per aiutarti a decidere quale dei composti di ogni coppia forma il coniugato più basico dopo la deprotonazione in acqua.
a) NH4+ o NH3 b) HCN o HSCN c) NH3 o H2O
Contributori
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)
Altre letture
MasterOrganicChemistry
Reazioni acido-base 4 – pKa
Reazioni acido-base 5 – Come usare il pKa
.Acid-Base Reactions 5 – How to Use a pKa Table
The pKa Table is Your Friend
Khan Academy
Ka and pKa Derivation
Websites
Wikipedia – Acid Dissociation Constants
Acidity, basicità e pKa (PDF)