8.3: pKa Values
É útil ter uma forma de comparar as acidez Bronsted-Lowry de diferentes compostos. Se a química dos prótons envolver a passagem de um local mais ácido para um local menos ácido, então o local que liga o próton de forma mais apertada irá reter o próton, e o local que liga os prótons de forma menos apertada irá perder o próton. Se soubermos quais os sítios que ligam os prótons com mais força, podemos prever em que direcção um próton será transferido.
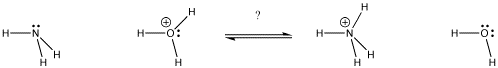
Figure AB9.1. Em que direcção se encontrará o equilíbrio? Que base obtém o próton?
Há um parâmetro determinado experimentalmente que nos diz até que ponto os prótons estão ligados a diferentes compostos. “Experimental” implica frequentemente para os estudantes “não testado” ou “não fiável”, mas aqui significa que alguém fez o trabalho de medir até que ponto o protão está ligado a diferentes compostos. Experimental neste sentido significa “baseado em provas físicas”.
Este parâmetro experimental é chamado “o pKa”. O pKa mede o quão apertado um próton é segurado por um ácido Bronsted. Um pKa pode ser um número pequeno e negativo, tal como -3 ou -5. Pode ser um número maior e positivo, tal como 30 ou 50. Quanto mais baixa a pKa de um ácido Bronsted, mais facilmente desiste do seu protão. Quanto mais alto o pKa de um ácido Bronsted, mais apertado é o protão, e menos facilmente o protão é cedido.
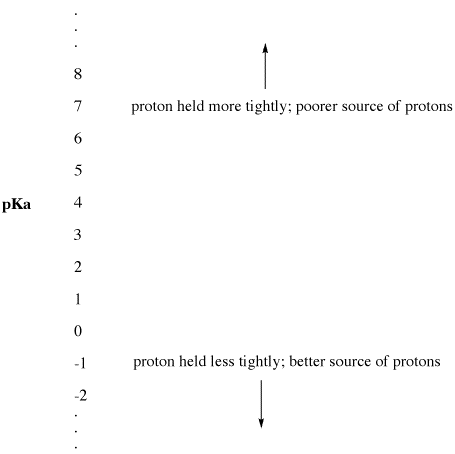
Figure AB9.2. A escala pKa como um índice de disponibilidade de protões.
- PKa baixo significa que um protão não é segurado firmemente.
- pKa pode por vezes ser tão baixo que é um número negativo!
PKa alto significa que um próton é mantido apertado.
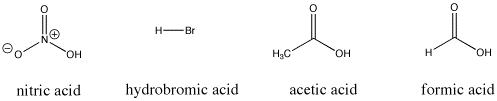
Figure AB9.3. Alguns compostos ácidos Bronsted; todos estes compostos fornecem protões com relativa facilidade.
Por exemplo, o ácido nítrico e o ácido clorídrico desistem ambos dos seus protões muito facilmente. O ácido nítrico na água tem um pKa de -1,3 e o ácido hidrobrómico tem um pKa de -9,0. Por outro lado, o ácido acético (encontrado no vinagre) e o ácido fórmico (o irritante nas picadas de formigas e abelhas) também desistirão dos protões, mas segurá-los-á um pouco mais firmemente. As suas pKas são relatadas como 4,76 e 3,77, respectivamente. A água não desiste de um próton muito facilmente; tem uma pKa de 15,7. O metano não é realmente um ácido, e tem um pKa estimado de cerca de 50,

Figure AB9.4. Alguns compostos não tão ácidos. A água é muito, muito fracamente ácida; o metano não é realmente ácido de todo.
O pKa mede a “força” de um ácido Bronsted. Um próton, H+, é um ácido Lewis forte; atrai pares de electrões muito eficazmente, de tal forma que está quase sempre ligado a um doador de electrões. Um ácido Bronsted forte é um composto que desiste do seu protão muito facilmente.
Um ácido Bronsted fraco é aquele que desiste do seu protão com mais dificuldade. Indo para um extremo mais distante, um composto do qual é muito, muito difícil remover um protão não é considerado de todo um ácido.
Quando um composto desiste de um protão, retém o par de electrões que anteriormente partilhava com o protão. Torna-se uma base conjugada. Visto de outra forma, um ácido Bronsted forte desiste facilmente de um protão, tornando-se uma base Bronsted fraca. A base de Bronsted não forma facilmente uma ligação com o protão. Não é boa a doar o seu par de electrões a um protão. Só o faz fracamente.
De forma semelhante, se um composto desistir de um protão e se tornar uma base forte, a base voltará facilmente a levar o protão de volta. Efectivamente, a base forte compete tão bem pelo protão que o composto permanece protonado. O composto continua a ser um ácido Bronsted em vez de ionizar e tornar-se a base forte conjugada. É um ácido Bronsted fraco.
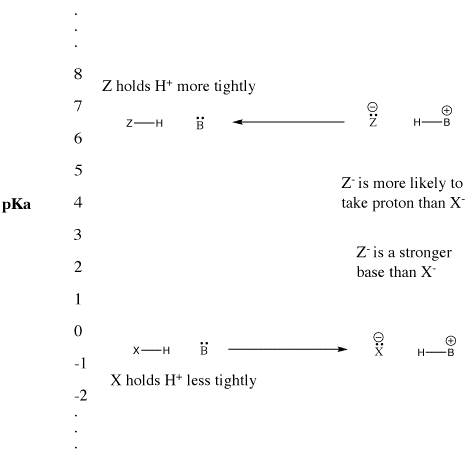
Figure AB9.5. A escala pKa e o seu efeito sobre bases conjugadas.
- “Forte” Os ácidos Bronsted ionizam facilmente para fornecer H+.
- Este termo é normalmente utilizado para descrever ácidos comuns tais como ácido sulfúrico e ácido hidrobrómico.
- “Fraco” Os ácidos bronsted não ionizam tão facilmente.
- Este termo é frequentemente utilizado para descrever ácidos comuns tais como ácido acético e ácido fluorídrico.
No entanto, os termos “forte” e “fraco” são realmente relativos. pKa valores que temos visto variam entre -5 e 50. Se algo com um pKa de 4 é descrito como um ácido fraco, o que é algo com um pKa de 25? Um ácido muito, muito fraco? É certamente uma melhor fonte de prótons do que algo com uma pKa de 35. É um ácido muito, muito, muito, muito, muito fraco? Quantos “verys” existem numa unidade pKa?
Esta ideia é também verdadeira quando se considera o oposto: uma base que pega num protão para formar um ácido conjugado. O quão apertado esse ácido conjugado detém um próton está relacionado com a força com que a base pode remover prótons de outros ácidos. Quanto mais fraco é algo como fonte de protões, mais forte é o seu conjugado como uma esponja de protões.
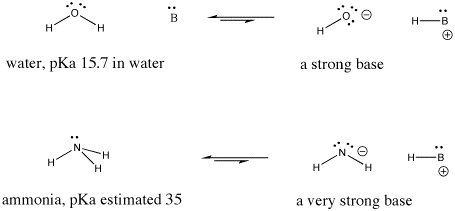
Figure AB9.6. Exemplos de uma base forte e uma ainda mais forte.
- Sejam cuidadosos. Os termos “ácido forte” e “ácido fraco” podem ser usados relativamente, em vez de absolutamente.
- O mesmo é válido para “base forte” e “base fraca”.
- Por vezes, se algo é chamado “forte” ou “fraco” depende do que mais está a ser comparado com.
Problema AB9.1.
Encontrar uma tabela pKa. Utilize-a para o ajudar a decidir qual dos seguintes pares é o ácido mais Bronsted na água.
a) HNO3 ou HNO2 b) H2Se ou H2O c) HCl ou H2SO4 d) Be(OH)2 ou HSeO3
Problema AB9.2.
Encontrar uma tabela pKa. Use-a para o ajudar a decidir qual dos compostos em cada par forma o conjugado mais básico após a desprotonificação na água.
a) NH4+ ou NH3 b) HCN ou HSCN c) NH3 ou H2O
Contribuidores
Chris P Schaller, Ph.D, (Colégio de São Bento / Universidade de São João)
Outra Leitura
MasterOrganicChemistry
Reacções ácido-base 4 – pKa
Acido–Reacções Base 5 – Como Usar uma Tabela pKa
A Tabela pKa é Sua Amiga
Academia Khan
Derivação Ka e pKa
Websites
Wikipedia – Constantes de Dissociação Ácida
Acidez, basicidade e pKa (PDF)