Isomère structurel
Equivalence structurelleEdit
On dit que deux molécules (y compris les ions polyatomiques) A et B ont la même structure si chaque atome de A peut être apparié avec un atome de B du même élément, de manière biunivoque, de sorte que pour chaque liaison dans A, il existe une liaison dans B, du même type, entre les atomes correspondants ; et vice versa. Cette exigence s’applique également aux liaisons complexes qui impliquent trois atomes ou plus, comme la liaison délocalisée dans la molécule de benzène et d’autres composés aromatiques.
Selon le contexte, on peut exiger que chaque atome soit apparié avec un atome du même isotope, et pas seulement du même élément.
Deux molécules peuvent alors être dites isomères structurels (ou, si les isotopes comptent, isotopomères structurels) si elles ont la même formule moléculaire mais n’ont pas la même structure.
Symétrie structurelle et atomes équivalentsModification
La symétrie structurelle d’une molécule peut être définie mathématiquement comme une permutation des atomes qui échange au moins deux atomes mais ne change pas la structure de la molécule. On peut alors dire que deux atomes sont structurellement équivalents s’il existe une symétrie structurelle qui ramène l’un à l’autre.
Ainsi, par exemple, les quatre atomes d’hydrogène du méthane sont structurellement équivalents, car toute permutation de ceux-ci préservera toutes les liaisons de la molécule.
De même, les six hydrogènes de l’éthane (C
2H
6) sont structurellement équivalents les uns aux autres, de même que les deux carbones ; car tout hydrogène peut être échangé avec n’importe quel autre, soit par une permutation qui échange seulement ces deux atomes, soit par une permutation qui échange les deux carbones et chaque hydrogène d’un groupe méthyle avec un hydrogène différent sur l’autre méthyle. L’une ou l’autre opération préserve la structure de la molécule. C’est le cas également pour les atomes d’hydrogène du cyclopentane, de l’allène, du 2-butyne, de l’hexaméthylènetétramine, du prismane, du cubane, du dodécaèdre, etc.
En revanche, les atomes d’hydrogène du propane ne sont pas tous structurellement équivalents. Les six hydrogènes attachés aux premier et troisième carbones sont équivalents, comme dans l’éthane, et les deux attachés au carbone central sont équivalents entre eux ; mais il n’y a pas d’équivalence entre ces deux classes d’équivalence.
Symétrie et isomérie de positionModification
Les équivalences structurelles entre les atomes d’une molécule mère réduisent le nombre d’isomères de position que l’on peut obtenir en remplaçant ces atomes par un élément ou un groupe différent. Ainsi, par exemple, l’équivalence structurale entre les six hydrogènes de l’éthane C
2H
6 signifie qu’il n’existe qu’un seul isomère structural de l’éthanolCH
5OH, et non 6. Les huit hydrogènes du propane C
3H
8 sont répartis en deux classes d’équivalence structurelle (les six sur les groupes méthyles, et les deux sur le carbone central) ; il n’y a donc que deux isomères positionnels du propanol (1-propanol et 2-propanol). De même, il n’y a que deux isomères positionnels du butanol, et trois du pentanol ou de l’hexanol.
Rupture de symétrie par les substitutionsEdit
Une fois qu’une substitution est effectuée sur une molécule mère, sa symétrie structurelle est généralement réduite, ce qui signifie que les atomes qui étaient auparavant équivalents peuvent ne plus l’être. Ainsi, la substitution de deux ou plusieurs atomes équivalents par le même élément peut générer plus d’un isomère positionnel.
L’exemple classique est celui des dérivés du benzène. Ses six hydrogènes sont tous structurellement équivalents, de même que ses six carbones ; car la structure n’est pas modifiée si l’on permute les atomes d’une manière qui correspond à retourner la molécule ou à la faire tourner de multiples de 60 degrés. Par conséquent, le remplacement de n’importe quel hydrogène par du chlore ne donne qu’un seul chlorobenzène. Cependant, avec ce remplacement, les permutations d’atomes qui ont déplacé cet hydrogène ne sont plus valables. Il ne reste qu’une seule permutation, qui correspond au retournement de la molécule tout en gardant le chlore fixe. Les cinq hydrogènes restants se répartissent alors en trois classes d’équivalence différentes : celui qui est opposé au chlore constitue une classe à part (appelée position para), les deux plus proches du chlore forment une autre classe (ortho), et les deux restants constituent la troisième classe (méta). Ainsi, une deuxième substitution de l’hydrogène par le chlore peut donner trois isomères positionnels : 1,2- ou ortho-, 1,3- ou méta-, et 1,4- ou para-dichlorobenzène.
 |
 |
 |
| ortho-Dichlorobenzène | méta-.Dichlorobenzène | para-Dichlorobenzène |
| 1,2-Dichlorobenzène | 1,3-Dichlorobenzène | 1,4-Dichlorobenzène |
Pour la même raison, il n’existe qu’un seul phénol (hydroxybenzène), mais trois benzènediols ; et un seul toluène (méthylbenzène), mais trois toluols, et trois xylènes.
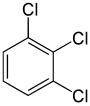
En revanche, le deuxième remplacement (par le même substituant) peut préserver ou même augmenter la symétrie de la molécule, et donc préserver ou réduire le nombre de classes d’équivalence pour le remplacement suivant. Ainsi, les quatre hydrogènes restants dans le méta-dichlorobenzène tombent toujours dans trois classes, tandis que ceux de l’ortho- tombent dans deux, et ceux du para- sont à nouveau tous équivalents. Malgré tout, certaines de ces 3 + 2 + 1 = 6 substitutions finissent par donner la même structure, de sorte qu’il n’y a que trois trichlorobenzènes structurellement distincts : 1,2,3-, 1,2,4-, et 1,3,5-.
 |
 |
 |
| 1,2,3-Trichlorobenzène | 1,2,4-Trichlorobenzène | 1,3,5-Trichlorobenzène |
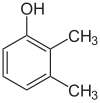
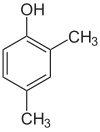
Si les substituants à chaque étape sont différents, il y aura généralement plus d’isomères structurels. Le xylénol, qui est du benzène avec un substituant hydroxyle et deux substituants méthyles, a un total de 6 isomères :
 |
 |
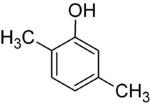 |
| 2,3-Xylénol | 2,4-Xylénol | 2,5-Xylénol |
 |
 |
 |
| 2,6-Xylénol | 3,4-Xylénol | 3,5-Xylénol |
.