Izomer strukturalny
Równoważność strukturalnaEdit
Mówi się, że dwie cząsteczki (w tym jony polatomowe) A i B mają taką samą strukturę, jeśli każdy atom A może być sparowany z atomem B tego samego pierwiastka, w sposób jeden do jednego, tak że dla każdego wiązania w A istnieje wiązanie w B, tego samego typu, pomiędzy odpowiadającymi atomami; i odwrotnie. Wymóg ten dotyczy również złożonych wiązań, które obejmują trzy lub więcej atomów, takich jak wiązanie delokalizowane w cząsteczce benzenu i innych związkach aromatycznych.
W zależności od kontekstu, można wymagać, aby każdy atom był sparowany z atomem tego samego izotopu, a nie tylko tego samego pierwiastka.
Dwie cząsteczki można wtedy uznać za izomery strukturalne (lub, jeśli izotopy mają znaczenie, izotopomery strukturalne), jeśli mają ten sam wzór molekularny, ale nie mają tej samej struktury.
Symetria strukturalna i atomy równoważneEdit
Symetrię strukturalną cząsteczki można zdefiniować matematycznie jako permutację atomów, która wymienia co najmniej dwa atomy, ale nie zmienia struktury cząsteczki. Dwa atomy można uznać za równoważne strukturalnie, jeśli istnieje symetria strukturalna, która przenosi jeden do drugiego.
Tak więc, na przykład, wszystkie cztery atomy wodoru w metanie są równoważne strukturalnie, ponieważ każda ich permutacja zachowa wszystkie wiązania cząsteczki.
Podobnie, wszystkie sześć hydrogenów etanu (C
2H
6) są strukturalnie równoważne sobie, podobnie jak dwa karbony; ponieważ każdy wodór może być zamieniony z każdym innym, albo przez permutację, która zamienia tylko te dwa atomy, albo przez permutację, która zamienia dwa karbony i każdy wodór w jednej grupie metylowej z innym wodorem na drugim metylu. Każda z tych operacji zachowuje strukturę cząsteczki. Tak jest również w przypadku atomów wodoru cyklopentanu, alenu, 2-butyny, heksametylenotetraminy, prismanu, kubanu, dodekaedru itd.
Z drugiej strony, atomy wodoru propanu nie są równoważne strukturalnie. Sześć hydrogenów przyłączonych do pierwszego i trzeciego węgla jest równoważnych, tak jak w etanie, a dwa przyłączone do środkowego węgla są równoważne sobie nawzajem; ale nie ma równoważności między tymi dwiema klasami równoważności.
Symetria i izomeria pozycyjnaEdit
Strukturalne równoważności między atomami macierzystej cząsteczki zmniejszają liczbę izomerów pozycyjnych, które można uzyskać przez zastąpienie tych atomów innym pierwiastkiem lub grupą. Tak więc, na przykład, równoważność strukturalna pomiędzy sześcioma hydrogenami etanu C
2H
6 oznacza, że istnieje tylko jeden izomer strukturalny etanoluCH
5OH, a nie 6. Osiem hydrogenów propanu C
3H
8 jest podzielonych na dwie klasy równoważności strukturalnej (sześć na grupach metylowych i dwa na węglu centralnym); dlatego istnieją tylko dwa izomery pozycyjne propanolu (1-propanol i 2-propanol). Podobnie istnieją tylko dwa izomery pozycyjne butanolu, i trzy pentanolu lub heksanolu.
Złamanie symetrii przez podstawnikiEdit
Po wprowadzeniu podstawnika do cząsteczki macierzystej, jej symetria strukturalna jest zwykle zmniejszona, co oznacza, że atomy, które wcześniej były równoważne, nie mogą już takie być. Tak więc zastąpienie dwóch lub więcej równoważnych atomów tym samym elementem może generować więcej niż jeden izomer pozycyjny.
Klasycznym przykładem są pochodne benzenu. Jego sześć hydrogenów są strukturalnie równoważne, tak samo jak sześć węgli, ponieważ struktura nie zmienia się, jeśli atomy są permutowane w sposób, który odpowiada odwróceniu cząsteczki lub obróceniu jej o wielokrotność 60 stopni. Dlatego też zastąpienie jakiegokolwiek wodoru chlorem daje tylko jeden chlorobenzen. Jednakże, z tym zastąpieniem, permutacje atomu, które przeniosły wodór nie są już ważne. Pozostaje tylko jedna permutacja, która odpowiada odwróceniu cząsteczki, przy jednoczesnym zachowaniu stałego chloru. Pięć pozostałych hydrogenów należy do trzech różnych klas równoważności: ten naprzeciwko chloru jest klasą samą w sobie (nazywaną pozycją para), dwa najbliżej chloru tworzą kolejną klasę (orto), a pozostałe dwa są trzecią klasą (meta). Tak więc drugie zastąpienie wodoru chlorem może dać trzy izomery pozycyjne: 1,2- lub orto, 1,3- lub meta-, i 1,4- lub para-dichlorobenzen.
 |
 |
 |
| ortho-Dichlorobenzene | meta-.Dichlorobenzen | para-Dichlorobenzen |
| 1,2-Dichlorobenzen | 1,3-Dichlorobenzen | 1,4-Dichlorobenzen |
Z tego samego powodu istnieje tylko jeden fenol (hydroksybenzen), ale trzy benzenodiole; i jeden toluen (metylobenzen), ale trzy toluole i trzy ksyleny.
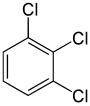
Z drugiej strony, drugie zastąpienie (przez ten sam podstawnik) może zachować lub nawet zwiększyć symetrię cząsteczki, a tym samym może zachować lub zmniejszyć liczbę klas równoważności dla następnego zastąpienia. Tak więc, cztery pozostałe hydrogeny w meta-dichlorobenzenie nadal należą do trzech klas, podczas gdy te z orto należą do dwóch, a te z para- są ponownie równoważne. Jednak niektóre z tych 3 + 2 + 1 = 6 podstawień dają w końcu tę samą strukturę, więc istnieją tylko trzy strukturalnie różne trichlorobenzeny: 1,2,3-, 1,2,4- i 1,3,5-.
 |
 |
 |
| 1,2,3-Trichlorobenzen | 1,2,4-Trichlorobenzen | 1,3,5-Trichlorobenzen |
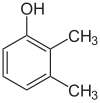
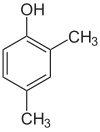
Jeśli podstawniki na każdym etapie są różne, zwykle będzie więcej izomerów strukturalnych. Ksylenol, który jest benzenem z jednym podstawnikiem hydroksylowym i dwoma podstawnikami metylowymi, ma w sumie 6 izomerów:
 |
 |
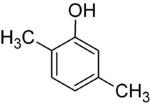 |
| 2,3-Xylenol | 2,4-Xylenol | 2,5-Xylenol |
 |
 |
 |
| 2,6-Xylenol | 3,4-Xylenol | 3,5-Xylenol |