Isómero estructural
Equivalencia estructuralEditar
Se dice que dos moléculas (incluidos los iones poliatómicos) A y B tienen la misma estructura si cada átomo de A puede emparejarse con un átomo de B del mismo elemento, de forma unívoca, de modo que para cada enlace en A existe un enlace en B, del mismo tipo, entre los átomos correspondientes; y viceversa. Este requisito se aplica también a los enlaces complejos que implican tres o más átomos, como el enlace deslocalizado en la molécula de benceno y otros compuestos aromáticos.
Dependiendo del contexto, se puede exigir que cada átomo esté emparejado con un átomo del mismo isótopo, no sólo del mismo elemento.
Entonces se puede decir que dos moléculas son isómeros estructurales (o, si los isótopos importan, isotopómeros estructurales) si tienen la misma fórmula molecular pero no tienen la misma estructura.
Simetría estructural y átomos equivalentesEditar
La simetría estructural de una molécula se puede definir matemáticamente como una permutación de los átomos que intercambia al menos dos átomos pero no cambia la estructura de la molécula. Se puede decir entonces que dos átomos son estructuralmente equivalentes si existe una simetría estructural que lleva uno a otro.
Así, por ejemplo, los cuatro átomos de hidrógeno del metano son estructuralmente equivalentes, porque cualquier permutación de los mismos conservará todos los enlaces de la molécula.
De la misma manera, los seis hidrógenos del etano (C
2H
6) son estructuralmente equivalentes entre sí, al igual que los dos carbonos; porque cualquier hidrógeno puede ser intercambiado con cualquier otro, ya sea por una permutación que intercambie sólo esos dos átomos, o por una permutación que intercambie los dos carbonos y cada hidrógeno de un grupo metilo con un hidrógeno diferente en el otro metilo. Cualquiera de las dos operaciones preserva la estructura de la molécula. Este es el caso también de los átomos de hidrógeno del ciclopentano, el aleno, el 2-buteno, la hexametilentetramina, el prismano, el cubano, el dodecaedrano, etc.
En cambio, los átomos de hidrógeno del propano no son todos estructuralmente equivalentes. Los seis hidrógenos unidos al primer y tercer carbono son equivalentes, como en el etano, y los dos unidos al carbono del medio son equivalentes entre sí; pero no hay equivalencia entre estas dos clases de equivalencia.
Simetría e isomería posicionalEditar
Las equivalencias estructurales entre los átomos de una molécula madre reducen el número de isómeros posicionales que se pueden obtener sustituyendo esos átomos por un elemento o grupo diferente. Así, por ejemplo, la equivalencia estructural entre los seis hidrógenos del etano C
2H
6 significa que sólo hay un isómero estructural del etanolCH
5OH, no 6. Los ocho hidrógenos del propano C
3H
8 se reparten en dos clases de equivalencia estructural (los seis de los grupos metilo y los dos del carbono central); por tanto, sólo hay dos isómeros posicionales del propanol (1-propanol y 2-propanol). Del mismo modo, sólo hay dos isómeros posicionales de butanol, y tres de pentanol o hexanol.
Ruptura de la simetría por sustitucionesEditar
Una vez que se realiza una sustitución en una molécula madre, su simetría estructural suele reducirse, lo que significa que los átomos que antes eran equivalentes pueden dejar de serlo. Así, la sustitución de dos o más átomos equivalentes por el mismo elemento puede generar más de un isómero posicional.
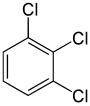
El ejemplo clásico son los derivados del benceno. Sus seis hidrógenos son todos estructuralmente equivalentes, al igual que los seis carbonos; porque la estructura no se modifica si los átomos se permutan de forma que corresponda a voltear la molécula o girarla en múltiplos de 60 grados. Por lo tanto, si se sustituye cualquier hidrógeno por cloro, sólo se obtiene un clorobenceno. Sin embargo, con esa sustitución, las permutaciones de átomos que movían ese hidrógeno ya no son válidas. Sólo queda una permutación, que corresponde a voltear la molécula manteniendo el cloro fijo. Los cinco hidrógenos restantes entran entonces en tres clases de equivalencia diferentes: el opuesto al cloro es una clase por sí mismo (llamada posición para), los dos más cercanos al cloro forman otra clase (orto), y los dos restantes son la tercera clase (meta). Así, una segunda sustitución de hidrógeno por cloro puede dar lugar a tres isómeros posicionales: 1,2- u orto-, 1,3- o meta-, y 1,4- o para-diclorobenceno.
 |
 |
 |
|
| meta-Diclorobenceno | para-diclorobenceno | ||
| 1,2-Diclorobenceno | 1,3-Diclorobenceno | 1,4-Diclorobenceno |
Por la misma razón, sólo hay un fenol (hidroxibenceno), pero tres bencenedioles y un tolueno (metilbenceno), pero tres toluoles y tres xilenos.
Por otro lado, la segunda sustitución (por el mismo sustituyente) puede conservar o incluso aumentar la simetría de la molécula, y por tanto puede conservar o reducir el número de clases de equivalencia para la siguiente sustitución. Así, los cuatro hidrógenos restantes del metadeclorobenceno siguen cayendo en tres clases, mientras que los del orto caen en dos y los del para son todos equivalentes de nuevo. Aun así, algunas de estas 3 + 2 + 1 = 6 sustituciones acaban dando la misma estructura, por lo que sólo hay tres triclorobencenos estructuralmente distintos: 1,2,3-, 1,2,4- y 1,3,5-.
 |
 |
|
| 1,2,3-Triclorobenceno | 1,2,4-Triclorobenceno | 1,3,5-Triclorobenceno |
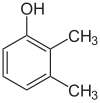
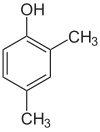
Si los sustituyentes en cada paso son diferentes, normalmente habrá más isómeros estructurales. El xilenol, que es benceno con un sustituyente hidroxilo y dos sustituyentes metilo, tiene un total de 6 isómeros:
 |
 |
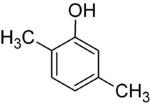 |
| 2,3-Xilenol | 2,4-Xilenol | 2,5-Xilenol |
 |
 |
 |
| 2,6-Xilenol | 3,4-Xilenol | 3,5-Xilenol |