Isómero estrutural
Equivalência estruturalEditar
Uma diz que duas moléculas (incluindo iões poliatómicos) A e B têm a mesma estrutura se cada átomo de A puder ser emparelhado com um átomo de B do mesmo elemento, de forma a que para cada ligação em A haja uma ligação em B, do mesmo tipo, entre átomos correspondentes; e vice-versa. Este requisito aplica-se também às ligações complexas que envolvem três ou mais átomos, tais como a ligação deslocalizada na molécula de benzeno e outros compostos aromáticos.
Dependente do contexto, pode-se exigir que cada átomo seja emparelhado com um átomo do mesmo isótopo, e não apenas do mesmo elemento.
Duas moléculas podem então ser consideradas isómeros estruturais (ou, se os isótopos forem matéria, isotopómeros estruturais) se tiverem a mesma fórmula molecular mas não tiverem a mesma estrutura.
Simetria estrutural e átomos equivalentesEditar
Simetria estrutural de uma molécula pode ser definida matematicamente como uma permutação dos átomos que troca pelo menos dois átomos mas não altera a estrutura da molécula. Pode-se então dizer que dois átomos são estruturalmente equivalentes se houver uma simetria estrutural que leva um ao outro.
Assim, por exemplo, todos os quatro átomos de hidrogénio de metano são estruturalmente equivalentes, porque qualquer permutação dos mesmos preservará todas as ligações da molécula.
Likewise, todos os seis hidrogênios do etano (C
2H
6) são estruturalmente equivalentes um ao outro, tal como os dois carbonos; porque qualquer hidrogénio pode ser trocado com qualquer outro, quer por uma permutação que troca apenas esses dois átomos, quer por uma permutação que troca os dois carbonos e cada hidrogénio de um grupo metílico com um hidrogénio diferente no outro metílico. Qualquer uma das operações preserva a estrutura da molécula. É o caso também para os átomos de hidrogénio ciclopentano, aleno, 2-butyne, hexametilenotetramina, prismane, cubano, dodecahedrano, etc.
Por outro lado, os átomos de hidrogénio do propano não são todos estruturalmente equivalentes. Os seis hidrogênios ligados ao primeiro e terceiro carbonos são equivalentes, como no etano, e os dois ligados ao carbono médio são equivalentes um ao outro; mas não há equivalência entre estas duas classes de equivalência.
Simetria e isomerismo posicionalEditar
Equivalências estruturais entre átomos de uma molécula mãe reduzem o número de isómeros posicionais que podem ser obtidos pela substituição desses átomos por um elemento ou grupo diferente. Assim, por exemplo, a equivalência estrutural entre os seis hidrogénios do etano C
2H
6 significa que existe apenas um isómero estrutural de etanolCH
5OH, não 6. Os oito hidrogénios de propano C
3H
8 estão divididos em duas classes de equivalência estrutural (os seis nos grupos metilo, e os dois no carbono central); por conseguinte, existem apenas dois isómeros posicionais de propanol (1-propanol e 2-propanol). Do mesmo modo, existem apenas dois isómeros posicionais de butanol, e três de pentanol ou hexanol.
Quebra de simetria por substituiçõesEditar
Após uma substituição é feita numa molécula mãe, a sua simetria estrutural é normalmente reduzida, o que significa que átomos que anteriormente eram equivalentes podem já não o ser. Assim, a substituição de dois ou mais átomos equivalentes pelo mesmo elemento pode gerar mais do que um isómero posicional.
O exemplo clássico são os derivados do benzeno. Os seus seis hidrogénios são todos estruturalmente equivalentes, tal como os seis carbonos; porque a estrutura não é alterada se os átomos forem permutados de forma a corresponderem à viragem da molécula ou à sua rotação por múltiplos de 60 graus. Portanto, a substituição de qualquer hidrogénio por cloro produz apenas um clorobenzeno. No entanto, com essa substituição, as permutações de átomos que moviam esse hidrogénio já não são válidas. Resta apenas uma permutação, que corresponde a virar a molécula enquanto se mantém o cloro fixo. Os cinco hidrogênios restantes dividem-se então em três classes de equivalência diferentes: a oposta ao cloro é uma classe por si só (chamada posição para), as duas mais próximas do cloro formam outra classe (ortho), e as duas restantes são a terceira classe (meta). Assim, uma segunda substituição de hidrogénio por cloro pode produzir três isómeros posicionais: 1,2- ou orto-, 1,3- ou meta-, e 1,4- ou para-diclorobenzeno.
 |
 |
 |
| ortho-Dichlorobenzene | meta-Diclorobenzeno | para-Diclorobenzeno |
| 1,2-Diclorobenzeno | 1,3-Diclorobenzeno | 1,4-Diclorobenzeno |
Pela mesma razão, existe apenas um fenol (hidroxibenzeno), mas três benzenodióis; e um tolueno (metilbenzeno), mas três toluóis, e três xilenos.
Por outro lado, a segunda substituição (pelo mesmo substituto) pode preservar ou mesmo aumentar a simetria da molécula, e assim preservar ou reduzir o número de classes de equivalência para a próxima substituição. Assim, os quatro hidrogénicos restantes do meta-diclorobenzeno ainda se enquadram em três classes, enquanto que os do orto- caem em duas, e os do para- são todos novamente equivalentes. Ainda assim, algumas destas 3 + 2 + 1 = 6 substituições acabam por produzir a mesma estrutura, pelo que existem apenas três triclorobenzenos estruturalmente distintos: 1,2,3-, 1,2,4-, e 1,3,5-.
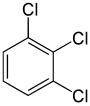 |
 |
 |
| 1,2,3-Triclorobenzeno | 1,2,4-Triclorobenzeno | 1,3,5-Triclorobenzeno |
Se os substitutos em cada passo forem diferentes, haverá normalmente mais isómeros estruturais. Xylenol, que é benzeno com um substituto hidroxil e dois substitutos metílicos, tem um total de 6 isómeros:
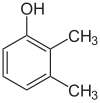 |
div>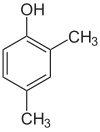 |
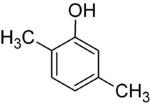 |
| 2,3-Xylenol | 2,4-Xylenol | 2,5-Xylenol |
 |
 |
 |
| 2,6-Xylenol | 3,4-Xylenol | 3,5-Xylenol |