Isomero strutturale
Equivalenza strutturaleModifica
Si dice che due molecole (compresi gli ioni poliatomici) A e B hanno la stessa struttura se ogni atomo di A può essere accoppiato con un atomo di B dello stesso elemento, in modo uno a uno, in modo che per ogni legame in A esiste un legame in B, dello stesso tipo, tra atomi corrispondenti; e viceversa. Questo requisito si applica anche ai legami complessi che coinvolgono tre o più atomi, come il legame delocalizzato nella molecola del benzene e altri composti aromatici.
A seconda del contesto, si può richiedere che ogni atomo sia accoppiato con un atomo dello stesso isotopo, non solo dello stesso elemento.
Due molecole possono essere dette isomeri strutturali (o, se gli isotopi contano, isotopomeri strutturali) se hanno la stessa formula molecolare ma non hanno la stessa struttura.
Simmetria strutturale e atomi equivalentiModifica
La simmetria strutturale di una molecola può essere definita matematicamente come una permutazione degli atomi che scambia almeno due atomi ma non cambia la struttura della molecola. Due atomi possono quindi dirsi strutturalmente equivalenti se esiste una simmetria strutturale che porta l’uno all’altro.
Così, per esempio, tutti e quattro gli atomi di idrogeno del metano sono strutturalmente equivalenti, perché qualsiasi permutazione di essi conserva tutti i legami della molecola.
Similmente, tutti i sei idrogeni dell’etano (C
2H
6) sono strutturalmente equivalenti tra loro, così come i due carboni; perché ogni idrogeno può essere scambiato con qualsiasi altro, sia con una permutazione che scambia solo quei due atomi, sia con una permutazione che scambia i due carboni e ogni idrogeno in un gruppo metile con un idrogeno diverso sull’altro metile. Entrambe le operazioni conservano la struttura della molecola. Questo è il caso anche degli atomi di idrogeno del ciclopentano, dell’allene, del 2-butano, dell’esametilenetramina, del prismane, del cubano, del dodecaedrano, ecc. I sei idrogeni attaccati al primo e al terzo carbonio sono equivalenti, come nell’etano, e i due attaccati al carbonio centrale sono equivalenti tra loro; ma non c’è equivalenza tra queste due classi di equivalenza.
Simmetria e isomeria posizionaleModifica
Le equivalenze strutturali tra gli atomi di una molecola madre riducono il numero di isomeri posizionali che possono essere ottenuti sostituendo quegli atomi con un elemento o un gruppo diverso. Così, per esempio, l’equivalenza strutturale tra i sei idrogeni dell’etano C
2H
6 significa che c’è un solo isomero strutturale di etanoloCH
5OH, non 6. Gli otto idrogeni del propano C
3H
8 sono suddivisi in due classi di equivalenza strutturale (i sei sui gruppi metilici e i due sul carbonio centrale); quindi ci sono solo due isomeri posizionali del propanolo (1-propanolo e 2-propanolo). Allo stesso modo ci sono solo due isomeri posizionali del butanolo, e tre del pentanolo o dell’esanolo.
Rottura di simmetria per sostituzioniModifica
Una volta che una sostituzione è fatta su una molecola madre, la sua simmetria strutturale è di solito ridotta, il che significa che gli atomi che prima erano equivalenti non possono più esserlo. Così la sostituzione di due o più atomi equivalenti con lo stesso elemento può generare più di un isomero posizionale.
L’esempio classico sono i derivati del benzene. I suoi sei idrogeni sono tutti strutturalmente equivalenti, così come i sei carboni; perché la struttura non cambia se gli atomi vengono permutati in modi che corrispondono a capovolgere la molecola o a ruotarla di multipli di 60 gradi. Pertanto, sostituendo qualsiasi idrogeno con il cloro si ottiene solo un clorobenzene. Tuttavia, con questa sostituzione, le permutazioni di atomi che hanno spostato quell’idrogeno non sono più valide. Rimane solo una permutazione, che corrisponde a capovolgere la molecola mantenendo il cloro fisso. I cinque idrogeni rimanenti rientrano allora in tre diverse classi di equivalenza: quello opposto al cloro è una classe a sé (chiamata posizione para), i due più vicini al cloro formano un’altra classe (ortho), e i due rimanenti sono la terza classe (meta). Così una seconda sostituzione di idrogeno con il cloro può produrre tre isomeri posizionali: 1,2- o ortho-, 1,3- o meta-, e 1,4- o para-diclorobenzene.
 |
 |
 |
| orto-diclorobenzene | meta-Diclorobenzene | para-diclorobenzene |
| 1,2-Diclorobenzene | 1,3-Diclorobenzene | 1,4-Diclorobenzene |
Per la stessa ragione, esiste un solo fenolo (idrossibenzene), ma tre benzenedioli; e un toluene (metilbenzene), ma tre toluoli e tre xileni.
D’altra parte, la seconda sostituzione (con lo stesso sostituente) può conservare o addirittura aumentare la simmetria della molecola, e quindi può conservare o ridurre il numero di classi di equivalenza per la sostituzione successiva. Così, i quattro idrogeni rimanenti nel meta-diclorobenzene rientrano ancora in tre classi, mentre quelli di ortho- rientrano in due, e quelli di para- sono di nuovo tutti equivalenti. Ancora, alcune di queste 3 + 2 + 1 = 6 sostituzioni finiscono per dare la stessa struttura, così ci sono solo tre triclorobenzeni strutturalmente distinti: 1,2,3-, 1,2,4-, e 1,3,5-.
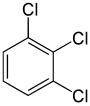 |
 |
 |
| 1,2,3-Triclorobenzene | 1,2,4-Triclorobenzene | 1,3,5-Triclorobenzene |
Se i sostituenti in ogni fase sono diversi, ci saranno solitamente più isomeri strutturali. Lo xilenolo, che è benzene con un sostituente idrossile e due sostituenti metilici, ha un totale di 6 isomeri:
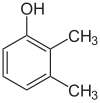 |
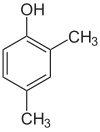 |
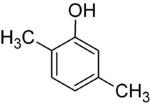 |
| 2,3-Xilenolo | 2,4-Xilenolo | 2,5-Xilenolo |
 |
 |
 |
| 2,6-Xilenolo | 3,4-Xilenolo | 3,5-Xilenolo |