MakeTheBrainHappy
Créé par MakeTheBrainHappy
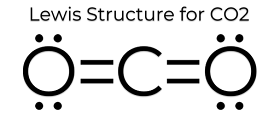
La structure en points de Lewis du CO2 lui confère certaines propriétés uniques. Comme il n’y a pas de paires solitaires sur l’atome, c’est une structure linéaire qui fait que les charges l’annulent. Il est donc non polaire et relativement peu réactif. Ces propriétés, ajoutées à son petit état, font que le dioxyde de carbone a un point de fusion bas et se trouve principalement en phase gazeuse à la température et à la pression standard (STP). Même si le dioxyde de carbone est assez petit, sa densité est tout de même 1,67 fois celle de l’air.
Un bloc solide de CO2. Les forces FMI (intermoléculaires) qui maintiennent cette structure sont si faibles que le cube passe directement de la phase solide à la phase gazeuse. Le CO2 est solide à -78,5 ˚C. Source
D’autres structures de points de Lewis pour le CO2 existent-elles ?
Oui, même si ce ne seraient pas les structures les plus courantes en raison des charges formelles. Vous pouvez en savoir plus sur ce qu’est une charge formelle dans cet article. Un exemple de structure de résonance possible consisterait à faire des doubles liaisons de la structure lewis dot des liaisons simples, puis à donner les électrons supplémentaires à chacun des atomes d’oxygène. Cela donnerait à chaque atome d’oxygène une charge formelle de -1 et à l’atome de carbone une charge formelle de +2. Bien que cela s’équilibrerait techniquement, ce serait peu probable en raison de la nature covalente des liaisons, même si les liaisons elles-mêmes sont polaires.
Le carbone forme-t-il habituellement des liaisons comme celle-ci ?
Oui, le carbone combiné à un autre élément crée habituellement des structures non polaires parce que le carbone peut former des liaisons multiples et a rarement des électrons solitaires. Il peut facilement remplir son exigence d’octuor avec presque n’importe quelle combinaison d’éléments et son électronégativité lui permet de se lier avec de nombreux types d’atomes différents. Les exceptions notables sont les composés CN (cyanure) et CO (monoxyde de carbone), dont la liaison est polaire en raison du partage inégal des électrons entre les deux atomes de la structure. Les structures ne ressemblent pas à la structure de point de lewis pour le CO2, où le carbone n’a pas d’électrons de paire solitaire sur le carbone.

La structure de Lewis pour le monoxyde de carbone avec des électrons de paire solitaire sur le carbone. Source

La structure de Lewis pour le cyanure avec des électrons solitaires sur le carbone. Source
