MakeTheBrainHappy
Erstellt von MakeTheBrainHappy
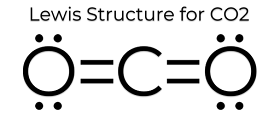
Die Lewis-Punkt-Struktur von CO2 verleiht ihm einige einzigartige Eigenschaften. Da es keine einsamen Paare am Atom gibt, ist es eine lineare Struktur, wodurch sich die Ladungen aufheben. Daher ist es unpolar und relativ unreaktiv. Diese Eigenschaften zusätzlich zu seinem kleinen Zustand machen es so, dass Kohlendioxid einen niedrigen Schmelzpunkt hat und bei STP (Standard Temperature and Pressure) meist in der Gasphase vorliegt. Obwohl Kohlendioxid recht klein ist, beträgt seine Dichte immer noch das 1,67-fache der Dichte von Luft.
Ein fester Block aus CO2. Die IMF (intermolekularen) Kräfte, die diese Struktur zusammenhalten, sind so schwach, dass der Würfel direkt von der festen in die gasförmige Phase übergeht. CO2 ist bei -78,5 ˚C fest. Quelle
Gibt es noch andere Lewis-Punkt-Strukturen für CO2?
Ja, obwohl dies aufgrund der formalen Ladungen nicht die häufigsten Strukturen wären. Was formale Ladung ist, können Sie in diesem Artikel nachlesen. Ein Beispiel für eine mögliche Resonanzstruktur wäre, die Doppelbindungen in der Lewis-Punkt-Struktur zu Einfachbindungen zu machen und dann die zusätzlichen Elektronen an jedes der Sauerstoffatome zu geben. Dadurch würde jedes Sauerstoffatom eine formale Ladung von -1 und das Kohlenstoffatom eine formale Ladung von +2 erhalten. Während sich dies technisch ausgleichen würde, wäre es aufgrund der kovalenten Natur der Bindungen unwahrscheinlich, obwohl die Bindungen selbst polar sind.
Bildet Kohlenstoff normalerweise solche Bindungen?
Ja, Kohlenstoff kombiniert mit einem anderen Element erzeugt normalerweise unpolare Strukturen, weil Kohlenstoff Mehrfachbindungen bilden kann und selten einsame Paarelektronen hat. Er kann seinen Oktettbedarf mit fast jeder Kombination von Elementen leicht ausfüllen und seine Elektronegativität erlaubt ihm, sich mit vielen verschiedenen Arten von Atomen zu verbinden. Die bemerkenswerten Ausnahmen sind die Verbindungen CN (Cyanid) und CO (Kohlenmonoxid), bei denen die Bindung aufgrund der ungleichen Aufteilung der Elektronen zwischen den beiden Atomen in der Struktur polar ist. Die Strukturen sehen nicht so aus wie die Lewis-Punkt-Struktur für CO2, bei der der Kohlenstoff keine einsamen Paarelektronen am Kohlenstoff hat.

Die Lewis-Struktur für Kohlenmonoxid mit einsamen Paarelektronen am Kohlenstoff. Quelle

Die Lewis-Struktur für Cyanid mit einsamen Elektronenpaaren am Kohlenstoff. Quelle
