MakeTheBrainHappy
br>
br>>p>Criado por MakeTheBrainHappybr>
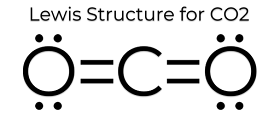
br> A estrutura de pontos de Lewis do CO2 confere-lhe algumas propriedades únicas. Uma vez que não existem pares isolados no átomo, é uma estrutura linear que faz com que as cargas o cancelem. Por conseguinte, é não-polar e relativamente pouco reactivo. Estas propriedades, para além do seu pequeno estado, fazem com que o dióxido de carbono tenha um ponto de fusão baixo e se encontre principalmente na fase gasosa em STP (Standard Temperature and Pressure). Embora o dióxido de carbono seja bastante pequeno, a sua densidade é ainda 1,67 vezes a do ar.
br>>p>p>Um bloco sólido de CO2. As forças (intermoleculares) que mantêm esta estrutura unida são tão fracas que o cubo vai directamente da fase sólida para a fase gasosa. O CO2 é sólido a -78,5 ˚C. Fonte br>Existem outras estruturas lewis dot para CO2?
sim, embora estas não sejam as estruturas mais comuns devido a acusações formais. Pode saber mais sobre o que é uma acusação formal neste artigo. Um exemplo de uma possível estrutura de ressonância seria fazer as ligações duplas na estrutura de pontos de lewis e depois dar os electrões extra a cada um dos átomos de oxigénio. Isto daria a cada átomo de oxigénio uma carga formal -1 e ao átomo de carbono uma carga formal +2. Embora tecnicamente isto se equilibrasse, seria improvável devido à natureza covalente das ligações, embora as próprias ligações sejam polares.
O carbono normalmente forma ligações como esta?
Sim, o carbono combinado com outro elemento normalmente cria estruturas não polares porque o carbono pode formar ligações múltiplas e raramente tem pares de electrões solitários. Pode facilmente preencher a sua necessidade de octeto com quase qualquer combinação de elementos e a sua electronegatividade permite-lhe ligar-se com muitos tipos diferentes de átomos. As excepções notáveis são os compostos CN (cianeto) e CO (monóxido de carbono), cuja ligação é polar devido à partilha desigual dos electrões entre os dois átomos da estrutura. As estruturas não se parecem com a estrutura de pontos de Lewis para CO2, onde o carbono não tem nenhum par de electrões isolados no carbono.

br>
A Estrutura de Lewis para Monóxido de Carbono com par de electrões isolados no carbono. Fonte
 br>>>p>> A Estrutura de Lewis para Monóxido de Carbono com electrões de par solitário no carbono. Fonte
br>>>p>> A Estrutura de Lewis para Monóxido de Carbono com electrões de par solitário no carbono. Fonte
