MakeTheBrainHappy
Creato da MakeTheBrainHappy
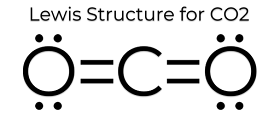
La struttura a punti di Lewis del CO2 gli conferisce alcune proprietà uniche. Poiché non ci sono coppie solitarie sull’atomo, è una struttura lineare che fa sì che le cariche si annullino. Perciò è non polare e relativamente poco reattivo. Queste proprietà, oltre al suo piccolo stato, fanno sì che l’anidride carbonica abbia un basso punto di fusione e sia per lo più in fase gassosa a STP (temperatura e pressione standard). Anche se l’anidride carbonica è piuttosto piccola, la sua densità è ancora 1,67 volte quella dell’aria.
Un blocco solido di CO2. Le forze IMF (intermolecolari) che tengono insieme questa struttura sono così deboli che il cubo passa direttamente dalla fase solida a quella gassosa. La CO2 è solida a -78,5 ˚C. Fonte
Esistono altre strutture a punti di Lewis per la CO2?
Sì, anche se queste non sarebbero le strutture più comuni a causa delle cariche formali. Puoi imparare di più su cosa sia la carica formale in questo articolo. Un esempio di una possibile struttura di risonanza sarebbe quello di rendere i doppi legami nella struttura a punti di Lewis legami singoli e poi dare gli elettroni extra a ciascuno degli atomi di ossigeno. Questo darebbe ad ogni atomo di ossigeno una carica formale -1 e all’atomo di carbonio una carica formale +2. Mentre questo tecnicamente si bilancerebbe, sarebbe improbabile a causa della natura covalente dei legami anche se i legami stessi sono polari.
Il carbonio di solito forma legami come questo?
Sì, il carbonio combinato con un altro elemento di solito crea strutture non polari perché il carbonio può formare legami multipli e raramente ha elettroni di coppia solitaria. Può facilmente riempire il suo requisito di ottetto con quasi tutte le combinazioni di elementi e la sua elettronegatività gli permette di legarsi con molti tipi diversi di atomi. Le eccezioni degne di nota sono i composti CN (cianuro) e CO (monossido di carbonio), il cui legame è polare a causa della condivisione ineguale di elettroni tra i due atomi nella struttura. Le strutture non assomigliano alla struttura a punti di Lewis per il CO2, dove il carbonio non ha elettroni di coppia solitaria sul carbonio.

La struttura di Lewis per il monossido di carbonio con elettroni di coppia solitaria sul carbonio. Fonte

La struttura di Lewis per il cianuro con elettroni di coppia solitaria sul carbonio. Fonte
.
