MakeTheBrainHappy
Created by MakeTheBrainHappy
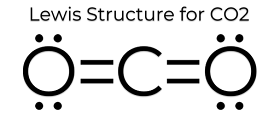
Struktura kropki Lewisa w CO2 nadaje mu pewne unikalne właściwości. Ponieważ nie ma samotnych par na atomie, jest to struktura liniowa, co sprawia, że ładunki się znoszą. Dlatego jest niepolarny i stosunkowo mało reaktywny. Te właściwości w połączeniu z małym stanem skupienia sprawiają, że dwutlenek węgla ma niską temperaturę topnienia i w większości znajduje się w fazie gazowej w STP (Standardowej Temperaturze i Ciśnieniu). Mimo że dwutlenek węgla jest dość mały, jego gęstość jest nadal 1,67 razy większa niż gęstość powietrza.
Stały blok CO2. Siły IMF (międzycząsteczkowe) trzymające tę strukturę razem są tak słabe, że sześcian przechodzi bezpośrednio z fazy stałej do gazowej. CO2 jest w stanie stałym w temperaturze -78,5˚C. Źródło
Czy istnieją inne struktury kropek Lewisa dla CO2?
Tak, chociaż nie byłyby to najczęściej spotykane struktury z powodu ładunków formalnych. Więcej o tym, czym jest ładunek formalny, można dowiedzieć się z tego artykułu. Przykładem możliwej struktury rezonansowej byłoby uczynienie wiązań podwójnych w strukturze kropki lewisa wiązaniami pojedynczymi, a następnie nadanie dodatkowych elektronów każdemu z atomów tlenu. To dałoby każdemu atomowi tlenu -1 ładunek formalny, a atomowi węgla +2 ładunek formalny. Chociaż technicznie byłoby to zrównoważone, byłoby to mało prawdopodobne ze względu na kowalencyjną naturę wiązań, mimo że same wiązania są polarne.
Czy węgiel zazwyczaj tworzy takie wiązania?
Tak, węgiel w połączeniu z innym elementem zazwyczaj tworzy struktury niepolarne, ponieważ węgiel może tworzyć wiele wiązań i rzadko ma samotną parę elektronów. Może on łatwo wypełnić swój wymóg oktetu z prawie każdą kombinacją pierwiastków, a jego elektronegatywność pozwala mu wiązać się z wieloma różnymi typami atomów. Godnymi uwagi wyjątkami są związki CN (cyjanek) i CO (tlenek węgla), których wiązanie jest polarne z powodu nierównego podziału elektronów pomiędzy dwa atomy w strukturze. Struktury te nie wyglądają tak jak struktura lewisa punktowa dla CO2, gdzie na węglu nie ma elektronów samotnej pary.

Struktura Lewisa dla tlenku węgla z elektronami samotnej pary na węglu. Źródło

Struktura Lewisa dla cyjanku z elektronami pary samotnej na węglu. Źródło
