MakeTheBrainHappy
Creada por MakeTheBrainHappy
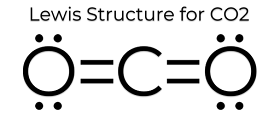
La estructura de puntos de Lewis del CO2 le confiere algunas propiedades únicas. Como no hay pares solitarios en el átomo, es una estructura lineal que hace que las cargas se cancelen. Por lo tanto, no es polar y es relativamente poco reactivo. Estas propiedades, además de su pequeño estado, hacen que el dióxido de carbono tenga un punto de fusión bajo y se encuentre mayoritariamente en fase gaseosa a STP (temperatura y presión estándar). Aunque el dióxido de carbono es bastante pequeño, su densidad sigue siendo 1,67 veces la del aire.
Un bloque sólido de CO2. Las fuerzas FMI (intermoleculares) que mantienen unida esta estructura son tan débiles que el cubo pasa directamente de la fase sólida a la gaseosa. El CO2 es sólido a -78,5 ˚C. Fuente
¿Existen otras estructuras de puntos de Lewis para el CO2?
Sí, aunque no serían las estructuras más comunes debido a las cargas formales. Puedes aprender más sobre qué es la carga formal en este artículo. Un ejemplo de una posible estructura de resonancia sería hacer que los dobles enlaces de la estructura de puntos de Lewis fueran enlaces simples y luego dar los electrones extra a cada uno de los átomos de oxígeno. Esto daría a cada átomo de oxígeno una carga formal de -1 y al átomo de carbono una carga formal de +2. Aunque técnicamente esto se equilibraría, sería poco probable debido a la naturaleza covalente de los enlaces, aunque los propios enlaces sean polares.
¿El carbono suele formar enlaces como éste?
Sí, el carbono combinado con otro elemento suele crear estructuras no polares porque el carbono puede formar enlaces múltiples y rara vez tiene electrones de par solitario. Puede llenar fácilmente su requisito de octeto con casi cualquier combinación de elementos y su electronegatividad le permite enlazar con muchos tipos diferentes de átomos. Las excepciones notables son los compuestos CN (cianuro) y CO (monóxido de carbono), cuyo enlace es polar debido al reparto desigual de electrones entre los dos átomos de la estructura. Las estructuras no se parecen a la estructura de puntos de lewis para el CO2, donde el carbono no tiene ningún electrón de par solitario en el carbono.

La estructura de Lewis para el monóxido de carbono con electrones de par solitario en el carbono. Fuente

La estructura de Lewis para el cianuro con electrones del par solitario en el carbono. Fuente
