MakeTheBrainHappy
Gemaakt door MakeTheBrainHappy
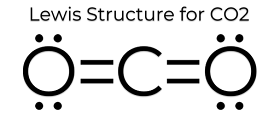
De lewis dot structuur van CO2 geeft het enkele unieke eigenschappen. Omdat er geen eenzame paren op het atoom zijn, is het een lineaire structuur, waardoor de ladingen elkaar opheffen. Daarom is het niet polair en relatief niet-reactief. Deze eigenschappen, in combinatie met zijn kleine toestand, maken dat kooldioxide een laag smeltpunt heeft en zich meestal in de gasfase bevindt bij STP (standaard temperatuur en druk). Hoewel kooldioxide vrij klein is, is de dichtheid ervan nog steeds 1,67 maal die van lucht.
Een vast blok CO2. De IMF-krachten (intermoleculaire krachten) die deze structuur bijeenhouden, zijn zo zwak dat het blokje rechtstreeks van de vaste in de gasvormige fase overgaat. CO2 is vast bij -78,5 ˚C.
Zijn er nog andere lewis dot-structuren voor CO2?
Ja, hoewel dit niet de meest voorkomende structuren zijn, vanwege de formele lading. In dit artikel kunt u meer lezen over wat formele lading is. Een voorbeeld van een mogelijke resonantiestructuur zou zijn om van de dubbele bindingen in de lewis dotstructuur enkele bindingen te maken en vervolgens de extra elektronen aan elk van de zuurstofatomen te geven. Dit zou elk zuurstofatoom een -1 formele lading geven en het koolstofatoom een +2 formele lading. Hoewel dit technisch gezien in evenwicht zou zijn, zou het onwaarschijnlijk zijn vanwege de covalente aard van de bindingen, ook al zijn de bindingen zelf polair.
Vormt koolstof meestal bindingen als deze?
Ja, koolstof in combinatie met een ander element creëert meestal apolaire structuren, omdat koolstof meerdere bindingen kan vormen en zelden alleenpaar-elektronen heeft. Het kan gemakkelijk zijn octet vullen met bijna elke combinatie van elementen en zijn elektronegativiteit maakt het mogelijk om te binden met veel verschillende soorten atomen. De opmerkelijke uitzonderingen zijn de verbindingen CN (cyanide) en CO (koolmonoxide), waarvan de binding polair is door de ongelijke verdeling van elektronen tussen de twee atomen in de structuur. De structuren lijken niet op de lewispuntstructuur voor CO2, waar de koolstof geen lone paar elektronen op de koolstof heeft.

De Lewisstructuur voor koolstofmonoxide met lone paar elektronen op de koolstof. Bron

De Lewisstructuur voor Cyanide met eenpaar elektronen op de koolstof. Bron
